Agilent 1100/1200 semipräparativ: Unterschied zwischen den Versionen
Cbier (Diskussion | Beiträge) Keine Bearbeitungszusammenfassung |
Jbaum (Diskussion | Beiträge) |
||
| (61 dazwischenliegende Versionen von 2 Benutzern werden nicht angezeigt) | |||
| Zeile 1: | Zeile 1: | ||
==<pre style="color: red">!!!IN DAS BENUTZERBUCH EINTRAGEN!!! NICHT VERGESSEN !!!!== | ==<pre style="color: red">!!!IN DAS BENUTZERBUCH EINTRAGEN!!! NICHT VERGESSEN!!!!== | ||
In das Benutzerhandbuch sollte der Name des Anwenders, die verwendete Säule und das verwendete Lösungsmittelgemisch und der entsprechende Rückdruck eingetragen werden. | In das Benutzerhandbuch sollte der Name des Anwenders, die verwendete Säule und das verwendete Lösungsmittelgemisch und der entsprechende Rückdruck eingetragen werden. | ||
== Aufbau == | == Aufbau == | ||
Eine HPLC setzt sich aus verschiedenen Baugruppen zusammen. Die semipräparative HPLC von | Eine HPLC setzt sich aus verschiedenen Baugruppen zusammen. Die semipräparative HPLC von Agilent aus Raum 309 besteht aus folgenden Baugruppen. | ||
{| class="wikitable" | {| class="wikitable" | ||
| Zeile 16: | Zeile 16: | ||
|style="width:200px;text-align:left; vertical-align:top;"| | |style="width:200px;text-align:left; vertical-align:top;"| | ||
|- | |- | ||
|valign=top|[[Degasser/ | |valign=top|[[Degasser/ Entgaser|Degasser/ Entgaser]] | ||
|style="text-align:left; vertical-align:top;"| G1379A/ JP13208442 | |style="text-align:left; vertical-align:top;"| G1379A/ JP13208442 | ||
|style="text-align:right; vertical-align:top;"| [[File: Degasser.jpg |top|center|thumb|140px|Degasser]] | |style="text-align:right; vertical-align:top;"| [[File: Degasser.jpg |top|center|thumb|140px|Degasser]] | ||
| Zeile 44: | Zeile 44: | ||
|- | |- | ||
|valign=top| [[Steuerelement |Steuerelement]] | |valign=top| [[Steuerelement |Steuerelement]] | ||
|style="text-align:left; vertical-align:top;"| | |style="text-align:left; vertical-align:top;"| G1323B/ CN23607228 | ||
|style="text-align:right; vertical-align:top;"| [[File:Steuerelement.jpg |top|center|thumb|140px|Steuerelement]] | |style="text-align:right; vertical-align:top;"| [[File:Steuerelement.jpg |top|center|thumb|140px|Steuerelement]] | ||
|style="text-align:left; vertical-align:top;"|[[:Datei: G1323_Steuermodul.pdf|Steuerelement]] | |style="text-align:left; vertical-align:top;"|[[:Datei: G1323_Steuermodul.pdf|Steuerelement]] | ||
| Zeile 71: | Zeile 71: | ||
== Vorbereitung == | == Vorbereitung == | ||
===Säule=== | ===Säule=== | ||
Vor der Inbetriebnahme der HPLC muss die gewünschte Säule eingebaut werden falls diese nicht bereits eingebaut ist. Es ist darauf zu achten, dass die verwendete Säule den gewünschten Bedingungen | Vor der Inbetriebnahme der HPLC muss die gewünschte Säule eingebaut werden, falls diese nicht bereits eingebaut ist. Es ist darauf zu achten, dass die verwendete Säule den gewünschten Bedingungen standhält (pH, Druck, Lösungsmittel etc.). Beim Einbau ist darauf zu achten, dass die Anschlüsse alle dicht sind. Nach dem Einbau der Säule kann diese, wenn gewünscht, im [[Säulenofen|Säulenofen]] temperiert werden. | ||
===Lösungsmittel=== | ===Lösungsmittel=== | ||
Vor jeder Messung ist es nötig den Füllstand der Lösungsmittelflaschen zu überprüfen und nach dem Auffüllen im Programm [[ Füllstand einstellen|einzustellen]] ([[Hinterkolbenspülung|Hinterkolbenspülung]] nicht vergessen). | |||
Es ist darauf zu achten, dass nur Lösungsmittel entsprechender Qualität verwendet werden. In ihnen dürfen sich keine Partikel befinden, da diese die Kapillaren und Ventile verstopfen würden. Korrosive Lösungen (z.B. Alkalilösungen, Salzlösungen und Halogensäuren) dürfen nicht verwendet werden! | |||
Die Lösungsmittel müssen mit der verwendeten Säule kompatibel sein, auch in Bezug auf den pH-Wert. | |||
Bei Flussraten größer 2 ml/min empfiehlt es sich die verwendeten Lösungsmittel zuvor zu [[Lösungsmittel entgasen|entgasen]]. | |||
Bei der Verwendung von Puffer-Lösungen müssen diese zuvor [[Lösungsmittel filtrieren|filtriert]] werden. | |||
Um bakterielles Wachstum zu unterbinden ist der Zusatz von 0,1 % TFA zum Lösungsmittel sinnvoll, ansonsten muss das Wasser bzw. das Wasser/Puffer-Gemisch alle 2 Tage getauscht werden. | |||
===Abfall=== | ===Abfall=== | ||
Alle Abfallbehälter sollten vor Messbeginn geprüft werden und | Alle Abfallbehälter sollten vor Messbeginn geprüft werden und bei Bedarf entsprechend geleert oder ausgetauscht werden ([[Hinterkolbenspülung|Hinterkolbenspülung]] nicht vergessen). | ||
===Proben=== | ===Proben=== | ||
Die Probenvorbereitung ist ein wichtiger Teil der HPLC-Analyse. Um Kontamination der Säule das Ausfallen der Probe auf der Säule zu vermeiden, ist es wichtig die Probe in einem entsprechenden Lösungsmittelverhältnis zu lösen und zu [[Probenfiltration mit Spritzenfilter| filtrieren]]. Die Probe sollte zu jeder Zeit gelöst sein und | Die Probenvorbereitung ist ein wichtiger Teil der HPLC-Analyse. Um Kontamination der Säule oder das Ausfallen der Probe auf der Säule zu vermeiden, ist es wichtig die Probe in einem entsprechenden Lösungsmittelverhältnis zu lösen und zu [[Probenfiltration mit Spritzenfilter| filtrieren]]. Die Probe sollte zu jeder Zeit gelöst sein und darf nicht im Laufmittelgemisch ausfallen. So ist es '''nicht''' sinnvoll bei RP-Phase die Probe in reinem Methanol oder ACN zu lösen, da die Gefahr groß ist, dass die Probe bei einem polareren Laufmittelgemisch auf der Säule ausfällt und nicht über die Säule transportiert wird. Das Ausfallen von Proben auf der Säule verursacht zum einen eine Steigerung des Rückdrucks bis hin zur Verstopfung der Säule, zum anderen wird die Bildung von Kanälen im Säulenmaterial gefördert, welches die Trennleistung verschlechtert. | ||
====In welchem Lösungsmittelgemisch soll ich nun meine Probe lösen?==== | ====In welchem Lösungsmittelgemisch soll ich nun meine Probe lösen?==== | ||
| Zeile 103: | Zeile 103: | ||
|- style="vertical-align:top;" | |- style="vertical-align:top;" | ||
|style="width:400px;text-align:left; vertical-align:top;"|Zum Starten der HPLC müssen zunächst die einzelnen Bauelemente angeschaltet werden. | |style="width:400px;text-align:left; vertical-align:top;"|Zum Starten der HPLC müssen zunächst die einzelnen Bauelemente angeschaltet werden. | ||
<p>'''(0)''' Rechner (falls dieser noch nicht läuft)<br> | |||
'''(1)''' [[Fraktionssammler |Fraktionssammler]]<br> | |||
'''(2)''' [[DAD-Detektor |DAD-Detektor]]<br> | |||
'''(3)''' [[Autosampler/ Injektor|Autosampler/ Injektor]]<br> | |||
'''(4)''' [[quaternäre Pumpe|quaternäre Pumpe]]<br> | |||
'''(5)''' [[Degasser/ Entgaser|Degasser/ Entgaser]]</p> | |||
|style="width:525px;text-align:left; vertical-align:top;"| [[File:HPLC_Schalter.png|top|center|thumb|500px|Startreihenfolge]] | |style="width:525px;text-align:left; vertical-align:top;"| [[File:HPLC_Schalter.png|top|center|thumb|500px|Startreihenfolge]] | ||
|- | |- | ||
| Zeile 127: | Zeile 129: | ||
|- | |- | ||
|- | |- | ||
|valign=top| Im erscheinenden Menü wird eine der ''Purge-Methoden'', abhängig von bei der Messung verwendeten Kanälen, gewählt. Will man z. B. später mit einer Mischung aus Methanol (Kanal C) und Wasser (Kanal A) die HPLC betreiben würde man Methode '' | |valign=top| Im erscheinenden Menü wird eine der ''Purge-Methoden'', abhängig von bei der Messung verwendeten Kanälen, gewählt. Will man z. B. später mit einer Mischung aus Methanol (Kanal C) und Wasser (Kanal A) die HPLC betreiben, würde man Methode ''_PURGE_AC_10MIN_2ML_MIN'' '''(1, 2)''' verwenden. | ||
_PURGE_AB_10MIN_2ML_MIN | |||
_PURGE_ABC_10MIN_2ML_MIN | |||
_PURGE_ABCD_10MIN_2ML_MIN | |||
_PURGE_AC_10MIN_2ML_MIN | |||
|style="text-align:left; vertical-align:top;"| [[File:Load_Method_b3.png|top|center|thumb|500px|Methode laden]] | |style="text-align:left; vertical-align:top;"| [[File:Load_Method_b3.png|top|center|thumb|500px|Methode laden]] | ||
| Zeile 148: | Zeile 150: | ||
|- | |- | ||
|- | |- | ||
|valign=top| Dabei wird die [[quaternäre Pumpe |Pumpe]] und der [[DAD-Detektor |DAD-Detektor]] | |valign=top| Dabei wird die [[quaternäre Pumpe |Pumpe]] und der [[DAD-Detektor |DAD-Detektor]] initialisiert. Im Schaubild färbt sich sobald das System bereit ist der ''"Pumpenpfeil"'' und die ''"DAD-Detektorwelle"'' grün. Danach läuft über den Purgeventil-Auslauf Lösungsmittel in den Lösungsmittelabfall. Die Lösungsmittelzuleitungen sollten 5-10 min gespült werden. Im Schlauchsystem von Lösungsmittelkabinett bis Purgeventil-Auslauf sollten idealerweise keine Luftblasen sein. Der eingebaute [[Degasser/ Entgaser|Degasser]] hat nur eine begrenzte Kapazität, so dass es bei hohen Flussraten nicht zur vollständigen Entgasung kommt. | ||
|style="text-align:left; vertical-align:top;"| [[File:Load_Method_b7.png|top|center|thumb|500px|Initialisierung der quaternären Pumpe und des DAD-Detektors]][[File:Load_Method_b8.png|top|center|thumb|500px|komplett eingeschaltetes System]][[File:Load_Method_b9.png|top|center|thumb|500px|Purgeventil-Auslauf]] | |style="text-align:left; vertical-align:top;"| [[File:Load_Method_b7.png|top|center|thumb|500px|Initialisierung der quaternären Pumpe und des DAD-Detektors]][[File:Load_Method_b8.png|top|center|thumb|500px|komplett eingeschaltetes System]][[File:Load_Method_b9.png|top|center|thumb|500px|Purgeventil-Auslauf]] | ||
|- | |- | ||
|- | |- | ||
|valign=top| Nach dem Reinigen wird die [[quaternäre Pumpe |Pumpe]] in ''"Standby"'' geschaltet, dabei färbt sich der der''"Pumpenpfeil"'' grau '''(1, 2, 3, 4)'''. Danach muss das Purgeventil geschlossen '''(5)''' werden. | |valign=top| Nach dem Reinigen wird die [[quaternäre Pumpe |Pumpe]] in ''"Standby"'' geschaltet, dabei färbt sich der der ''"Pumpenpfeil"'' grau '''(1, 2, 3, 4)'''. Danach muss das Purgeventil geschlossen '''(5)''' werden. | ||
|)style="text-align:left; vertical-align:top;"| [[File:Load_Method_b11.png|top|center|thumb|500px| Öffnen des Pumpenmenüs]][[File:Load_Method_b12.png|top|center|thumb|500px| Control]][[File:Load_Method_b13.png|top|center|thumb|500px|]][[File:Load_Method_b14.png|top|center|thumb|500px|Standby; OK]] [[File:Load_Method_b15.png|top|center|thumb|500px|Pumpe Standby (grau)]] [[File:Load_Method_b10.png|top|center|thumb|500px|Purgeventil schließen]] | |)style="text-align:left; vertical-align:top;"| [[File:Load_Method_b11.png|top|center|thumb|500px| Öffnen des Pumpenmenüs]][[File:Load_Method_b12.png|top|center|thumb|500px| Control]][[File:Load_Method_b13.png|top|center|thumb|500px|]][[File:Load_Method_b14.png|top|center|thumb|500px|Standby; OK]] [[File:Load_Method_b15.png|top|center|thumb|500px|Pumpe Standby (grau)]] [[File:Load_Method_b10.png|top|center|thumb|500px|Purgeventil schließen]] | ||
|- | |- | ||
| Zeile 158: | Zeile 160: | ||
== Methode editieren/ erstellen == | == Methode editieren/ erstellen == | ||
Um Substanzen auf der HPLC zu trennen braucht man eine Methode. Der einfachste Weg eine neue Methode zu erstellen besteht im | Um Substanzen auf der HPLC zu trennen braucht man eine Methode. Der einfachste Weg eine neue Methode zu erstellen besteht im Editieren einer vorhandenen Methode. | ||
{| class="wikitable" | {| class="wikitable" | ||
| Zeile 165: | Zeile 167: | ||
|- style="vertical-align:top;" | |- style="vertical-align:top;" | ||
|style="width:400px;text-align:; vertical-align:top;"|Zum editieren | |style="width:400px;text-align:; vertical-align:top;"|Zum editieren einer Methode muss der Menüreiter ''"Method"'' ausgewählt werden '''(1)''' und ''"Edit Entire Method..."'' angeklickt werden '''(2)'''. | ||
|style="width:525px;text-align:left; vertical-align:top;"| [[File:Load Method b16.png|top|center|thumb|500px|Methode editieren]] | |style="width:525px;text-align:left; vertical-align:top;"| [[File:Load Method b16.png|top|center|thumb|500px|Methode editieren]] | ||
|- style="vertical-align:top;" | |- style="vertical-align:top;" | ||
|style="width:400px;text-align:left; vertical-align:top;"|Die Editierung aller Bereiche mit | |style="width:400px;text-align:left; vertical-align:top;"|Die Editierung aller Bereiche mit OK '''(1)''' bestätigen. | ||
|style="width:525px;text-align:left; vertical-align:top;"| [[File:Load Method b17.png|top|center|thumb|500px|Ok]] | |style="width:525px;text-align:left; vertical-align:top;"| [[File:Load Method b17.png|top|center|thumb|500px|Ok]] | ||
| Zeile 176: | Zeile 178: | ||
|- style="vertical-align:top;" | |- style="vertical-align:top;" | ||
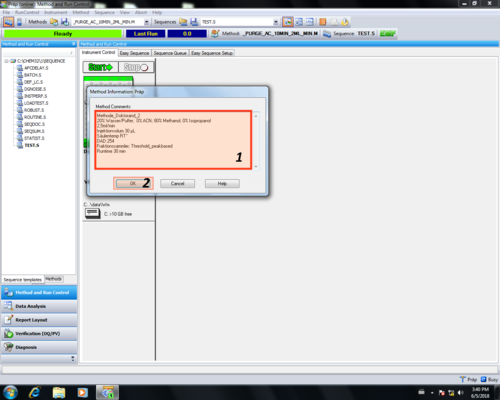
|style="width:400px;text-align:left; vertical-align:top;"|Im Methoden Informationsbereich sollte eine Übersicht der Methodenparameter eingetragen werden '''(1)''' und mit OK '''(2)''' bestätigt werden. | |style="width:400px;text-align:left; vertical-align:top;"|Im Methoden Informationsbereich sollte eine Übersicht der Methodenparameter eingetragen werden '''(1)''' und mit OK '''(2)''' bestätigt werden. | ||
<ul> | |||
<li>Name</li> | |||
<li>Lösungsmittel-Mischungsverhältnis</li> | |||
<li>Flussrate</li> | |||
<li>Injektionsvolumen</li> | |||
<li>Säulenofentemperatur</li> | |||
<li>Detektorwellenlänge</li> | |||
<li>Info Fraktionssammler</li> | |||
<li>Methodendauer</li> | |||
</ul> | |||
<p>In unserem Beispiel:</p> | |||
<ul> | |||
<li>Methode_Doktorand_2</li> | |||
<li>20% Wasser/Puffer; 0% Acetonitril; 80% Methanol; 0% Isopropanol</li> | |||
<li>2,5 mL/min</li> | |||
<li>30 µL</li> | |||
<li>RT</li> | |||
<li>254 nm</li> | |||
<li>threshold-peakbased</li> | |||
<li>30 min</li> | |||
</ul> | |||
Diese Informationen bilden | Diese Informationen bilden den Header des Reports einer Messung. | ||
|style="width:525px;text-align:left; vertical-align:top;"| | |style="width:525px;text-align:left; vertical-align:top;"| [[File:Load Method b19.png|top|center|thumb|500px|Methoden-Info]] | ||
|- | |- | ||
|- style="vertical-align:top;" | |- style="vertical-align:top;" | ||
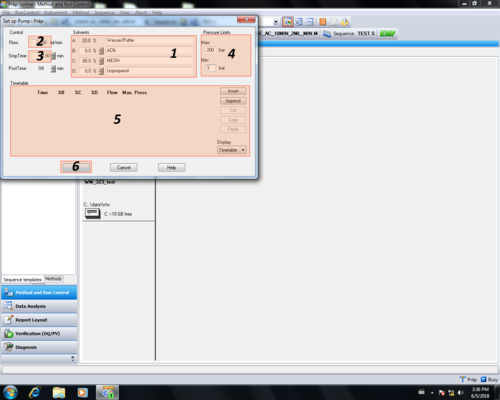
|style="width:400px;text-align:left; vertical-align:top;"|Im Pump-Einstellungsbereich können pumpenrelevante Parameter eingetragen werden und mit OK '''(6)''' bestätigt werden. | |style="width:400px;text-align:left; vertical-align:top;"|Im Pump-Einstellungsbereich können pumpenrelevante Parameter eingetragen werden und mit OK '''(6)''' bestätigt werden. | ||
<p>'''(1)''' Lösungsmittel-Mischungsverhältnis<br> | |||
'''(2)''' Flussrate<br> | |||
'''(3)''' Methodendauer<br> | |||
'''(4)''' Druck-Limits<br> | |||
'''(5)''' Gradienteneinstellungen</p> | |||
<p>In unserem Beispiel ''Methode_Doktorand_2'':</p> | |||
<p>'''(1)''' 20% Wasser/Puffer; 0% Acetonitril; 80% Methanol; 0% Isopropanol<br> | |||
'''(2)''' 2,5 mL/min<br> | |||
'''(3)''' 30 min<br> | |||
'''(4)''' 3-200bar (unteren Druck nur beim ''Purgen'' auf 0 bar setzen, ansonsten besteht die Gefahr, dass die Säule trocken läuft. Das obere Drucklimit ist durch die Druckbeständigkeit des Säulenmaterials und des [[DAD-Detektor | DAD-Detektors]] begrenzt.<br> | |||
In unserem Beispiel ''Methode_Doktorand_2'': | '''(5)''' isokratisch</p> | ||
|style="width:525px;text-align:left; vertical-align:top;"| [[File:Load Method b20.png|top|center|thumb|500px|Pumpen-Einstellung]] | |style="width:525px;text-align:left; vertical-align:top;"| [[File:Load Method b20.png|top|center|thumb|500px|Pumpen-Einstellung]] | ||
| Zeile 234: | Zeile 228: | ||
|style="width:400px;text-align:left; vertical-align:top;"|Im Injektions-Einstellungsbereich können injektionsrelevante Parameter eingetragen werden und mit OK '''(3)''' bestätigt werden. | |style="width:400px;text-align:left; vertical-align:top;"|Im Injektions-Einstellungsbereich können injektionsrelevante Parameter eingetragen werden und mit OK '''(3)''' bestätigt werden. | ||
<p>'''(1)''' Injektionsvolumen<br> | |||
'''(2)''' Injektionsart</p> | |||
:'''(2)''' Standard | <p>In unserem Beispiel ''Methode_Doktorand_2'':</p> | ||
<p>'''(1)''' 30 µL<br> | |||
'''(2)''' Standard</p> | |||
| Zeile 252: | Zeile 242: | ||
|style="width:400px;text-align:left; vertical-align:top;"|Im DAD-Detektor-Einstellungsbereich können detektorrelevante Parameter eingetragen werden und mit OK '''(5)''' bestätigt werden. | |style="width:400px;text-align:left; vertical-align:top;"|Im DAD-Detektor-Einstellungsbereich können detektorrelevante Parameter eingetragen werden und mit OK '''(5)''' bestätigt werden. | ||
<p>'''(1)''' Substanzwellenlängen (Wellenlänge bei dem die Substanz absorbiert), Referenzwellenlänge (liegt in der Regel höher als die zugehörige Signalwellenlänge, hier sollte das Lösungsmittel nicht absorbieren)<br> | |||
'''(2)''' Detektionszeit (stimmt in der Regel mit Methodendauer überein)<br> | |||
'''(3)''' verwendete Lampen (Lampen decken unterschiedliche Wellenbereiche ab UV bzw. Vis)<br> | |||
'''(4)''' UV-Spektrum (hier wird eingestellt zu welchem Zeitpunkt ein gesamtes UV-Absorptionsspektrum online mitgemessen wird)</p> | |||
In unserem Beispiel ''Methode_Doktorand_2'': | In unserem Beispiel ''Methode_Doktorand_2'': | ||
<p>'''(1)''' Sub: 254nm; Ref: 360nm<br> | |||
'''(2)''' 30min<br> | |||
'''(3)''' UV & Vis<br> | |||
'''(4)''' None</p> | |||
| Zeile 283: | Zeile 262: | ||
|style="width:400px;text-align:left; vertical-align:top;"|Im Fraktionssammler-Einstellungsbereich können Parameter, die den Fraktionssammler betreffen, eingetragen werden und mit OK '''(5)''' bestätigt werden. | |style="width:400px;text-align:left; vertical-align:top;"|Im Fraktionssammler-Einstellungsbereich können Parameter, die den Fraktionssammler betreffen, eingetragen werden und mit OK '''(5)''' bestätigt werden. | ||
<p>'''(1)''' Sammelart (zeitabhängig bzw. peakabhängig)<br> | |||
'''(2)''' max. Peakbreite (ist dieser Wert zu gering eingestellt wechselt das Auffanggefäß ständig)<br> | |||
'''(3)''' Detektorwahl mit Sammelparameter <br> | |||
'''(4)''' Wann gesammelt wird? (ob nur eine oder mehrere Bedingungen erfüllt sein müssen)</p> | |||
In unserem Beispiel ''Methode_Doktorand_2'': | In unserem Beispiel ''Methode_Doktorand_2'': | ||
<p>'''(1)''' Peak-based<br> | |||
'''(2)''' 6 min<br> | |||
'''(3)''' DAD-Detektor; Threshold only, Threshold Unit 10.0<br> | |||
'''(4)''' at least one selected peak detector (da nur ein Detektor angeschlossen ist, ist egal was man hier anklickt)</p> | |||
|style="width:525px;text-align:left; vertical-align:top;"| [[File:Load Method b23.png|top|center|thumb|500px|DAD-Einstellung]] | |style="width:525px;text-align:left; vertical-align:top;"| [[File:Load Method b23.png|top|center|thumb|500px|DAD-Einstellung]] | ||
|- style="vertical-align:top;" | |- style="vertical-align:top;" | ||
|style="width:400px;text-align:left; vertical-align:top;"|Im Messsignal-Einstellungsbereich können die Messsignale der Methode | |style="width:400px;text-align:left; vertical-align:top;"|Im Messsignal-Einstellungsbereich können die Messsignale der Methode zu sortiert werden und mit OK '''(2)''' bestätigt werden. | ||
'''(1)''' Signal (da nur ein Detektor angeschlossen ist, hat man die Wahl zwischen verschiedenen Wellenlängen). | |||
<p>In unserem Beispiel ''Methode_Doktorand_2'':<br> | |||
'''(1)''' DAD1 A, Sig=254nm</p> | |||
In unserem Beispiel ''Methode_Doktorand_2'': | |||
|style="width:525px;text-align:left; vertical-align:top;"| [[File:Load Method b24.png|top|center|thumb|500px|DAD-Einstellung]] | |style="width:525px;text-align:left; vertical-align:top;"| [[File:Load Method b24.png|top|center|thumb|500px|DAD-Einstellung]] | ||
|- style="vertical-align:top;" | |- style="vertical-align:top;" | ||
|style="width:400px;text-align:left; vertical-align:top;"|Im Report-Einstellungsbereich kann das Format des Reports angepasst werden. Da dies in den meisten Fällen für uns nicht relevant ist und später auch noch während der Auswertung entsprechend angepasst werden kann | |style="width:400px;text-align:left; vertical-align:top;"|Im Report-Einstellungsbereich kann das Format des Reports angepasst werden. Da dies in den meisten Fällen für uns nicht relevant ist und später auch noch während der Auswertung entsprechend angepasst werden kann, kann hier die Editierung mit Cancel '''(1)''' abgebrochen werden. | ||
| Zeile 336: | Zeile 301: | ||
|- style="vertical-align:top;" | |- style="vertical-align:top;" | ||
|style="width:400px;text-align:left; vertical-align:top;"| Zuletzt | |style="width:400px;text-align:left; vertical-align:top;"| Zuletzt muss die Methode gespeichert werden '''(1, 2)''' und ein gewünschter Methodenname gewählt werden '''(3, 4)'''. Ein Kommentar zur Änderung ist nicht nötig einfach mit OK '''(5)''' bestätigen. Die gespeicherte Methode wird automatisch geladen '''(6)'''. | ||
|style="width:525px;text-align:left; vertical-align:top;"| | |style="width:525px;text-align:left; vertical-align:top;"| | ||
| Zeile 346: | Zeile 311: | ||
== Messen == | == Messen == | ||
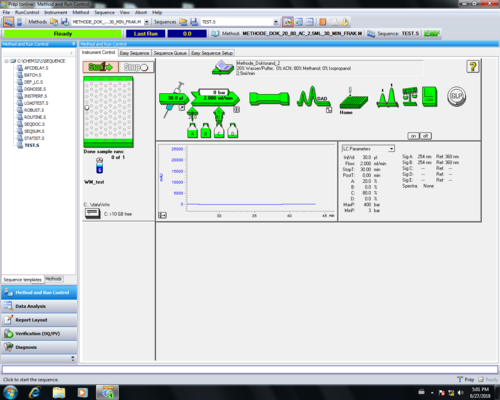
Nachdem durch "''Purgen''" die Luft aus den Zuleitungen gespült wurde kann eine zuvor erstellte Methode geladen werden und die Säule mit dem gewünschten Lösungsmittelgemisch | Nachdem durch "''Purgen''" die Luft aus den Zuleitungen gespült wurde kann eine zuvor erstellte Methode geladen werden und die Säule mit dem gewünschten Lösungsmittelgemisch ~30 min eingespült werden. Säulen mögen keine zu starken Wechsel in der Polarität des Laufmittels, so dass Wechsel von Laufmittelgemischen mit stark unterschiedlichen Polaritäten schrittweise erfolgen sollten, um Risse im Säulenbett vorzubeugen. Nach dem Einspülen der Säule müssen die vorbereiteten Proben in den Probentisch des Autosamplers gestellt werden und Angaben zu Position etc. in die Sequenztabelle eingetragen werden. | ||
===Probentabelle erstellen=== | ===Probentabelle erstellen=== | ||
| Zeile 355: | Zeile 320: | ||
|- style="vertical-align:top;" | |- style="vertical-align:top;" | ||
|style="width:400px;text-align:; vertical-align:top;"|Zum | |style="width:400px;text-align:; vertical-align:top;"|Zum Erstellen der Sequenztabelle muss zunächst das Probentischsymbol angeklickt werden '''(1)''' und der Menüreiter ''"Sequence Table"'' ausgewählt werden. '''(2)'''. | ||
|style="width:525px;text-align:left; vertical-align:top;"| [[File: | |style="width:525px;text-align:left; vertical-align:top;"| [[File:42_2.png|top|center|thumb|500px|Probentisch]] [[File:43_2.png|top|center|thumb|500px|Sequence table]] | ||
|- style="vertical-align:top;" | |- style="vertical-align:top;" | ||
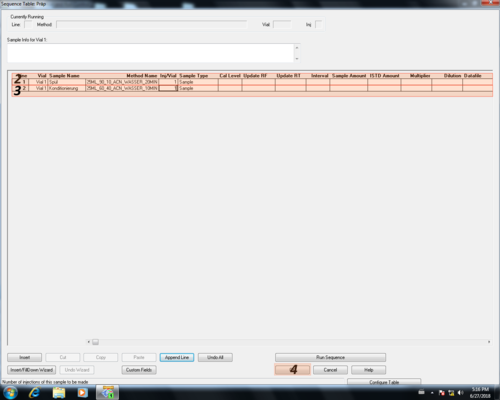
|style="width:400px;text-align:left; vertical-align:top;"|In der sich öffnenden Sequenztabelle kann die Position des Vials '''(1)''', der Name der Probe '''(2)''' die gewünschte Methode '''(3)''' und die Anzahl der Injektionen/Messungen '''(4)''' der Probe eingegeben werden. Will man mehr als eine Probe messen kann man durch klicken von ''"Insert"'' '''(5)''' eine neue Zeile oberhalb, durch klicken von ''"Append Line"'' '''(6)''' eine Zeile unterhalb einfügen und wie zuvor ausfüllen. Mit ''" Undo All"'' '''(7)''' stellt man den Ursprung der Tabelle wieder her. Nach der Eingabe aller zu vermessenden Proben wird die Eingabe mit '''(8)''' | |style="width:400px;text-align:left; vertical-align:top;"|In der sich öffnenden Sequenztabelle kann die Position des Vials '''(1)''', der Name der Probe '''(2)''' die gewünschte Methode '''(3)''' und die Anzahl der Injektionen/Messungen '''(4)''' der Probe eingegeben werden. Will man mehr als eine Probe messen kann man durch klicken von ''"Insert"'' '''(5)''' eine neue Zeile oberhalb, durch klicken von ''"Append Line"'' '''(6)''' eine Zeile unterhalb einfügen und wie zuvor ausfüllen. Mit ''" Undo All"'' '''(7)''' stellt man den Ursprung der Tabelle wieder her. Nach der Eingabe aller zu vermessenden Proben wird die Eingabe mit OK '''(8)''' bestätigt. | ||
|style="width:525px;text-align:left; vertical-align:top;"| [[File: | |style="width:525px;text-align:left; vertical-align:top;"| [[File:44_2.png|top|center|thumb|500px|Sequence table]] | ||
|- style="vertical-align:top;" | |- style="vertical-align:top;" | ||
|style="width:400px;text-align:; vertical-align:top;"|Nachdem man zurück ins ''" | |style="width:400px;text-align:; vertical-align:top;"|Nachdem man zurück ins ''"Hauptmenü"'' gekommen ist muss erneut das Probentischsymbol angeklickt werden '''(1)''', aber diesmal der Menüreiter ''"Sequence Parameters..."'' ausgewählt werden '''(2)'''. | ||
|style="width:525px;text-align:left; vertical-align:top;"| [[File: | |style="width:525px;text-align:left; vertical-align:top;"| [[File:42_2.png|top|center|thumb|500px|Probentisch]][[File:47_2.png|top|center|thumb|500px|Sequence Parameters]] | ||
|- style="vertical-align:top;" | |- style="vertical-align:top;" | ||
|style="width:400px;text-align:; vertical-align:top;"|In dem sich öffnenden | |style="width:400px;text-align:; vertical-align:top;"|In dem sich öffnenden Menüfenster kann der Speicherort der gemessenen Chromatogramme bestimmt werden '''(1)'''. Außerdem wird hier auch der Dateiname inklusive Nummerierung festgelegt wenn eine ganze Sequenz gemessen wird '''(3)'''. In diesem Menüfenster wird auch der Anwender eingetragen, der später auf dem Report erscheint '''(2)'''. Wurden alle Änderungen eingetragen bestättigt man diese mit OK '''(4)'''. | ||
|style="width:525px;text-align:left; vertical-align:top;"| [[File: | |style="width:525px;text-align:left; vertical-align:top;"| [[File:48_2.png|top|center|thumb|500px|Sequence Parameters]] | ||
|} | |} | ||
===Messung starten === | ===Messung starten === | ||
{| class="wikitable" | {| class="wikitable" | ||
| Zeile 379: | Zeile 345: | ||
! Erklärung !! Bild | ! Erklärung !! Bild | ||
|- style="vertical-align:top;" | |- style="vertical-align:top;" | ||
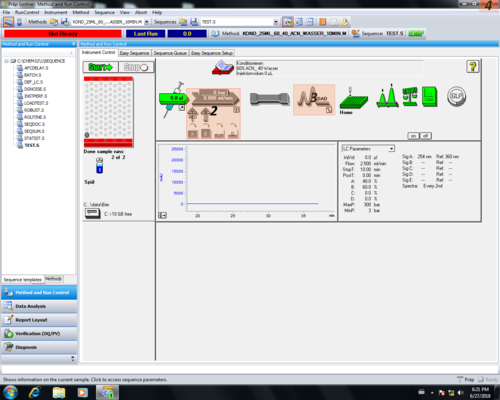
|style="width:400px;text-align:; vertical-align:top;"|Zurück im | |style="width:400px;text-align:; vertical-align:top;"|Zurück im Hauptmenü kann durch Anklicken von Start '''(1)''' die Messung gestartet werden. Bei laufender Messung sind die Symbole für Injektor, Säule und DAD-Detektor blau. | ||
|style="width:525px;text-align:left; vertical-align:top;"| [[File: | |style="width:525px;text-align:left; vertical-align:top;"| [[File:50_2.png|top|center|thumb|500px|Start]] [[File:53_2.png|top|center|thumb|500px|Messung]] | ||
|- style="vertical-align:top;" | |- style="vertical-align:top;" | ||
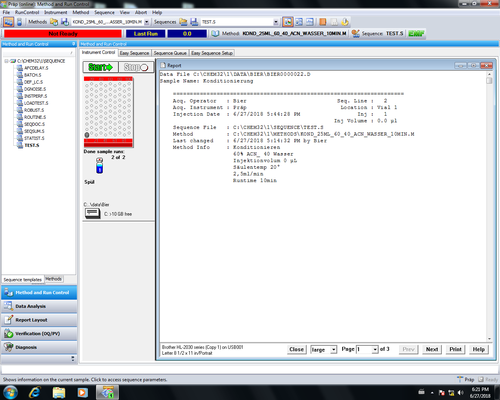
|style="width:400px;text-align:; vertical-align:top;"|Ist Messung fertig speichert sich | |style="width:400px;text-align:; vertical-align:top;"|Ist die Messung fertig speichert sich das Chromatogramm automatisch beim zuvor unter "''Sequence Parameter''" angegebenen Ort ab und es öffnet sich ein Report den man ausdrucken kann. Die Messdaten können später auch noch offline eingesehen und ausgewertet werden. | ||
|style="width:525px;text-align:left; vertical-align:top;"| [[File: | |style="width:525px;text-align:left; vertical-align:top;"| [[File:54_2.png|top|center|thumb|500px|fertige Messung]] | ||
|} | |} | ||
===Spülen=== | ===Spülen=== | ||
Hat man die letzte Messung beendet muss die Säule gespült werden und im vom Hersteller angegebenen Lösungsmittelgemisch gelagert werden. Üblicherweise werden die Säulen 20-30 min mit einem Lösungsmittelgemisch gespült, welches einen höheren organischen Anteil hat als jenes, welches zuvor für die Messung verwendet wurde. | Hat man die letzte Messung beendet muss die Säule gespült werden und im vom Hersteller angegebenen Lösungsmittelgemisch gelagert werden. Üblicherweise werden die Säulen 20-30 min mit einem Lösungsmittelgemisch gespült, welches einen höheren organischen Anteil hat als jenes, welches zuvor für die Messung verwendet wurde. Hierfür lädt man am besten eine entsprechende Spülmethode. Nach dem Spülen wechselt man dann zum vom Hersteller angegebenen Lösungsmittelgemisch und konditioniert sie für weitere 10 min, bevor man die Pumpe im Programm ausschaltet. | ||
{| class="wikitable" | {| class="wikitable" | ||
| Zeile 397: | Zeile 363: | ||
! Erklärung !! Bild | ! Erklärung !! Bild | ||
|- style="vertical-align:top;" | |- style="vertical-align:top;" | ||
|style="width:400px;text-align:; vertical-align:top;"|Eine Möglichkeit für die Spül- und | |style="width:400px;text-align:; vertical-align:top;"|Eine Möglichkeit für die Spül- und Konditionierungs-Prozedur besteht im Schreiben und Starten einer entsprechender Sequenz. Dazu ruft man den ''"Sequence Table"'' auf '''(1)''' und trägt hier eine Spül- '''(2)''' und Konditionierungs-Sequenz '''(3)''' ein. Anschließend bestätigt man diese mit OK '''(4)'''. | ||
|style="width:525px;text-align:left; vertical-align:top;"| [[File: | |style="width:525px;text-align:left; vertical-align:top;"| [[File:57_2.png|top|center|thumb|500px|''"Sequence table"'']] [[File:60_2.png|top|center|thumb|500px|''"Sequence table"'']] | ||
|- style="vertical-align:top;" | |- style="vertical-align:top;" | ||
|style="width:400px;text-align:; vertical-align:top;"|Im | |style="width:400px;text-align:; vertical-align:top;"|Im Folgenden ruft man das ''"Sequence Parameter"'' Menü auf '''(5)'''. Dort kann eingestellt werden, dass die UV-Lampe und die Pumpe in Standby geht, sobald die Messung der Sequenz beendet ist '''(6)'''. Diese Einstellung bestätigt man mit OK '''(7)''' und startet die Sequenz '''(8)'''. | ||
|style="width:525px;text-align:left; vertical-align:top;"| [[File: | |style="width:525px;text-align:left; vertical-align:top;"| [[File:61_2.png|top|center|thumb|500px|''"Sequence Parameter"'']][[File:62_2.png|top|center|thumb|500px|Messung]] | ||
|} | |} | ||
===Schließen=== | ===Schließen=== | ||
{| class="wikitable" | {| class="wikitable" | ||
| Zeile 411: | Zeile 378: | ||
|- style="vertical-align:top;" | |- style="vertical-align:top;" | ||
|style="width:400px;text-align:; vertical-align:top;"|Ist die | |style="width:400px;text-align:; vertical-align:top;"|Ist die Sequenz durchgelaufen, öffnet sich das Reportfenster und die Pumpe und die UV-Lampe schalten sich aus. Nun kann das Reportfenster geschlossen werden '''(1)'''. | ||
|style="width:525px;text-align:left; vertical-align:top;"|[[File: | |style="width:525px;text-align:left; vertical-align:top;"|[[File:64_2.png|top|center|thumb|500px|Lauf]] | ||
|- style="vertical-align:top;" | |- style="vertical-align:top;" | ||
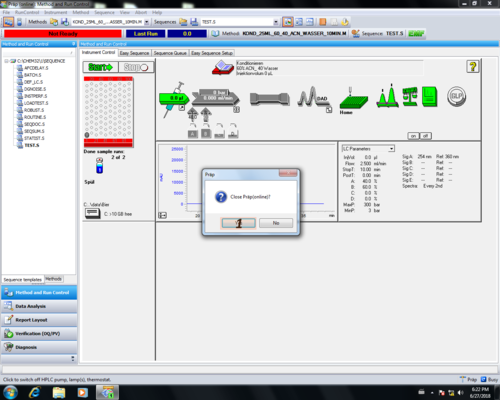
|style="width:400px;text-align:; vertical-align:top;"| Da die Pumpe und die UV-Lampe ausgeschalte sind (grau) '''(3 | |style="width:400px;text-align:; vertical-align:top;"| Da die Pumpe und die UV-Lampe ausgeschalte sind (grau) '''(2,3)''', kann auch das Programm ''Präp LC online'' geschlossen werden '''(4)'''. | ||
|style="width:525px;text-align:left; vertical-align:top;"|[[File: | |style="width:525px;text-align:left; vertical-align:top;"|[[File:66_2.png|top|center|thumb|500px|Programm schließen]] | ||
|- style="vertical-align:top;" | |||
|style="width:400px;text-align:; vertical-align:top;"| Die Nachfrage ob man das Programm wirklich schließen will kann einfach bestätigt werden '''(1)''', ebenso die Frage ob die Pumpe und die Lampe aus ist '''(2)''', sofern diese grau unterlegt sind. | |||
|style="width:525px;text-align:left; vertical-align:top;"|[[File:67_2.png|top|center|thumb|500px|Programm schließen]] [[File:68_2.png|top|center|thumb|500px|Programm schließen]][[File:69_2.png|top|center|thumb|500px|Programm schließen]] | |||
|- style="vertical-align:top;" | |- style="vertical-align:top;" | ||
|style="width:400px;text-align:; vertical-align:top;"| | |style="width:400px;text-align:; vertical-align:top;"| Nun können die einzelnen Bauteile der HPLC ausgeschaltet werden. | ||
|style="width:525px;text-align:left; vertical-align:top;"|[[File: | |style="width:525px;text-align:left; vertical-align:top;"|[[File:Aufbau_Nr.ausschalten.png|top|center|thumb|500px|HPLC ausschalten]] | ||
|} | |} | ||
== Auswerten == | == Auswerten == | ||
Die Auswertung kann entweder an Hand des ausgedruckten Reports oder an Hand eines im offline Programm ''(Präp LC offline)'' von Chemstation modifizierten Reports erfolgen. Von Interesse sind hierbei insbesondere die Retentionszeiten und Integrale der einzelnen Signale, auch das UV-Spektrum der einzelnen Signale gibt wichtige Hinweise. | |||
== Abschließende Hinweise == | == Abschließende Hinweise == | ||
Vor Verwendung der HPLC ist es sinnvoll seine Zielsetzung klar zu definieren. Für eine gute Dokumentation bietet es sich an bei jeder Messung einen [[:File:HPLC.pdf|Laufzettel]] zu verwenden, in dem alle Parameter der Messung vermerkt sind, um eine Reproduzierbarkeit bei erneuten Messungen zu gewährleisten. Ein [[:File:HPLC.pdf|Vordruck]] kann hier oder im Desktopbereich des HPLC-Computers gefunden werden und bei Bedarf ausgedruckt werden. | |||
Aktuelle Version vom 21. Juli 2021, 11:42 Uhr
!!!IN DAS BENUTZERBUCH EINTRAGEN!!! NICHT VERGESSEN!!!!
In das Benutzerhandbuch sollte der Name des Anwenders, die verwendete Säule und das verwendete Lösungsmittelgemisch und der entsprechende Rückdruck eingetragen werden.
Aufbau
Eine HPLC setzt sich aus verschiedenen Baugruppen zusammen. Die semipräparative HPLC von Agilent aus Raum 309 besteht aus folgenden Baugruppen.
 | |||||
|---|---|---|---|---|---|
| Baugruppe | Produktnummer/ Seriennummer | Foto | Herstelleranleitung | ||
| Lösungsmittel Kabinett |  |
||||
| Degasser/ Entgaser | G1379A/ JP13208442 | Degasser | |||
| Pumpe | G1311A/ DE82203503 |  |
quaternäre Pumpe | ||
| Autosampler/ Injektor | G1313A/ DE11116863 |  |
Autosampler; 900µL Injektorschleife | ||
| DAD-Detektor | G1315A/ DE82203687 |  |
DAD-Detektor | ||
| Fraktionssammler | G1364C/ DE63055760 |  |
Fraktionssammler | ||
| Steuerelement | G1323B/ CN23607228 |  |
Steuerelement | ||
| Säulenofen | ST 85P jet/ 50521 |  |
Säulenofen | ||
| Lösungsmittelabfall Hinterkolbenspülung |  |
||||
| Lösungsmittelabfall (Purgeventil (Pumpe)/ Injektor/ Fraktionssammler) |  |
||||
| Rechner (Windows 7) |  |
||||
Vorbereitung
Säule
Vor der Inbetriebnahme der HPLC muss die gewünschte Säule eingebaut werden, falls diese nicht bereits eingebaut ist. Es ist darauf zu achten, dass die verwendete Säule den gewünschten Bedingungen standhält (pH, Druck, Lösungsmittel etc.). Beim Einbau ist darauf zu achten, dass die Anschlüsse alle dicht sind. Nach dem Einbau der Säule kann diese, wenn gewünscht, im Säulenofen temperiert werden.
Lösungsmittel
Vor jeder Messung ist es nötig den Füllstand der Lösungsmittelflaschen zu überprüfen und nach dem Auffüllen im Programm einzustellen (Hinterkolbenspülung nicht vergessen). Es ist darauf zu achten, dass nur Lösungsmittel entsprechender Qualität verwendet werden. In ihnen dürfen sich keine Partikel befinden, da diese die Kapillaren und Ventile verstopfen würden. Korrosive Lösungen (z.B. Alkalilösungen, Salzlösungen und Halogensäuren) dürfen nicht verwendet werden! Die Lösungsmittel müssen mit der verwendeten Säule kompatibel sein, auch in Bezug auf den pH-Wert. Bei Flussraten größer 2 ml/min empfiehlt es sich die verwendeten Lösungsmittel zuvor zu entgasen. Bei der Verwendung von Puffer-Lösungen müssen diese zuvor filtriert werden. Um bakterielles Wachstum zu unterbinden ist der Zusatz von 0,1 % TFA zum Lösungsmittel sinnvoll, ansonsten muss das Wasser bzw. das Wasser/Puffer-Gemisch alle 2 Tage getauscht werden.
Abfall
Alle Abfallbehälter sollten vor Messbeginn geprüft werden und bei Bedarf entsprechend geleert oder ausgetauscht werden (Hinterkolbenspülung nicht vergessen).
Proben
Die Probenvorbereitung ist ein wichtiger Teil der HPLC-Analyse. Um Kontamination der Säule oder das Ausfallen der Probe auf der Säule zu vermeiden, ist es wichtig die Probe in einem entsprechenden Lösungsmittelverhältnis zu lösen und zu filtrieren. Die Probe sollte zu jeder Zeit gelöst sein und darf nicht im Laufmittelgemisch ausfallen. So ist es nicht sinnvoll bei RP-Phase die Probe in reinem Methanol oder ACN zu lösen, da die Gefahr groß ist, dass die Probe bei einem polareren Laufmittelgemisch auf der Säule ausfällt und nicht über die Säule transportiert wird. Das Ausfallen von Proben auf der Säule verursacht zum einen eine Steigerung des Rückdrucks bis hin zur Verstopfung der Säule, zum anderen wird die Bildung von Kanälen im Säulenmaterial gefördert, welches die Trennleistung verschlechtert.
In welchem Lösungsmittelgemisch soll ich nun meine Probe lösen?
Da für die semipräparative Reinigung in der Regel zuvor an der analytischen HPLC eine Methode entwickelt wurde, kann auf Grundlage der dabei gesammelten Erfahrung ein sinnvolles Probenlösungsmittelgemisch ausgewählt werden.
Fraktionssammler
Falls der Fraktionssammler verwendet werden soll muss dieser zuvor mit kleinen Probengläschen bestückt werden.
Starten
Vor dem Starten der HPLC ist es wichtig die entsprechenden Vorbereitungen (siehe vorherigen Absatz) zu treffen.
| Erklärung | Bild |
|---|---|
| Zum Starten der HPLC müssen zunächst die einzelnen Bauelemente angeschaltet werden.
(0) Rechner (falls dieser noch nicht läuft) |
 |
| Um die semipräparative HPLC zu starten muss zunächst die Verknüpfung "Präp LC online" mit einem Doppelklick (linke Maustaste) geöffnet werden. |  |
| Nach dem Klicken verbinden sich die Bauelemente der HPLC mit dem Rechner. |   |
| Nach dem sich der Fraktionssammler initialisiert hat (1) (~2 min, hierfür muss er geschlossen sein!!), muss eine Methode geladen werden (2). | 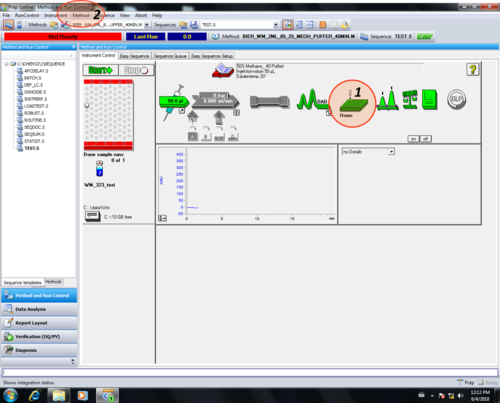 |
| Hierfür wird der Menüreiter "Load Method" (1) ausgewählt. |  |
| Im erscheinenden Menü wird eine der Purge-Methoden, abhängig von bei der Messung verwendeten Kanälen, gewählt. Will man z. B. später mit einer Mischung aus Methanol (Kanal C) und Wasser (Kanal A) die HPLC betreiben, würde man Methode _PURGE_AC_10MIN_2ML_MIN (1, 2) verwenden. _PURGE_AB_10MIN_2ML_MIN _PURGE_ABC_10MIN_2ML_MIN _PURGE_ABCD_10MIN_2ML_MIN _PURGE_AC_10MIN_2ML_MIN |  |
| Die Ausgewählte Methode wird im Programm angezeigt (1). | 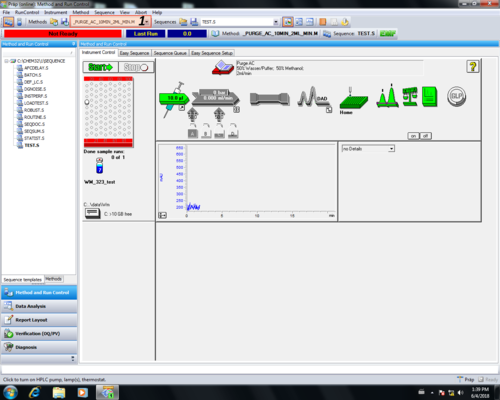 |
| Um das HPLC-System zu reinigen muss das Purgeventil geöffnet werden (1) und die HPLC gestartet werden (2). |   |
| Dabei wird die Pumpe und der DAD-Detektor initialisiert. Im Schaubild färbt sich sobald das System bereit ist der "Pumpenpfeil" und die "DAD-Detektorwelle" grün. Danach läuft über den Purgeventil-Auslauf Lösungsmittel in den Lösungsmittelabfall. Die Lösungsmittelzuleitungen sollten 5-10 min gespült werden. Im Schlauchsystem von Lösungsmittelkabinett bis Purgeventil-Auslauf sollten idealerweise keine Luftblasen sein. Der eingebaute Degasser hat nur eine begrenzte Kapazität, so dass es bei hohen Flussraten nicht zur vollständigen Entgasung kommt. |    |
| Nach dem Reinigen wird die Pumpe in "Standby" geschaltet, dabei färbt sich der der "Pumpenpfeil" grau (1, 2, 3, 4). Danach muss das Purgeventil geschlossen (5) werden. |   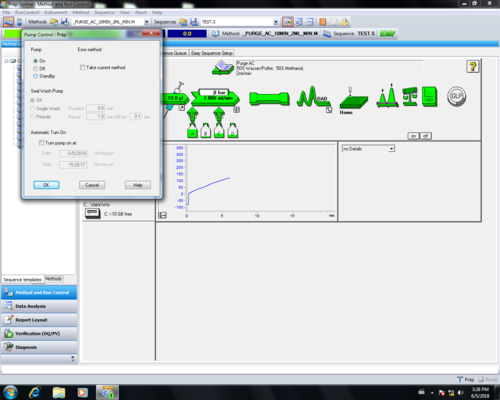 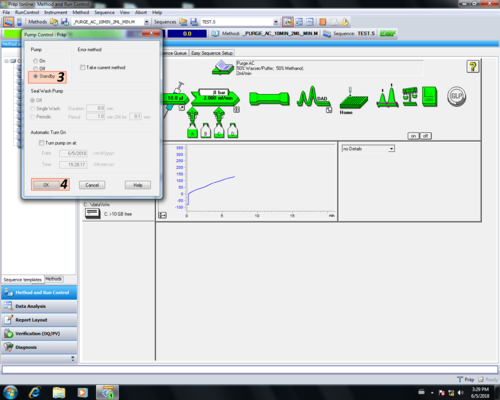   |
Methode editieren/ erstellen
Um Substanzen auf der HPLC zu trennen braucht man eine Methode. Der einfachste Weg eine neue Methode zu erstellen besteht im Editieren einer vorhandenen Methode.
| Erklärung | Bild |
|---|---|
| Zum editieren einer Methode muss der Menüreiter "Method" ausgewählt werden (1) und "Edit Entire Method..." angeklickt werden (2). |  |
| Die Editierung aller Bereiche mit OK (1) bestätigen. |  |
Im Methoden Informationsbereich sollte eine Übersicht der Methodenparameter eingetragen werden (1) und mit OK (2) bestätigt werden.
In unserem Beispiel:
|
 |
| Im Pump-Einstellungsbereich können pumpenrelevante Parameter eingetragen werden und mit OK (6) bestätigt werden.
(1) Lösungsmittel-Mischungsverhältnis In unserem Beispiel Methode_Doktorand_2: (1) 20% Wasser/Puffer; 0% Acetonitril; 80% Methanol; 0% Isopropanol |
 |
| Im Injektions-Einstellungsbereich können injektionsrelevante Parameter eingetragen werden und mit OK (3) bestätigt werden.
(1) Injektionsvolumen In unserem Beispiel Methode_Doktorand_2: (1) 30 µL |
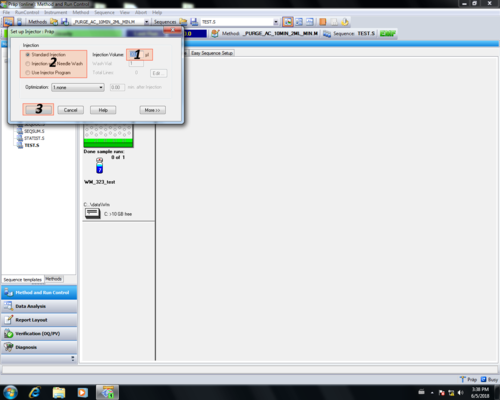 |
| Im DAD-Detektor-Einstellungsbereich können detektorrelevante Parameter eingetragen werden und mit OK (5) bestätigt werden.
(1) Substanzwellenlängen (Wellenlänge bei dem die Substanz absorbiert), Referenzwellenlänge (liegt in der Regel höher als die zugehörige Signalwellenlänge, hier sollte das Lösungsmittel nicht absorbieren) (1) Sub: 254nm; Ref: 360nm |
 |
| Im Fraktionssammler-Einstellungsbereich können Parameter, die den Fraktionssammler betreffen, eingetragen werden und mit OK (5) bestätigt werden.
(1) Sammelart (zeitabhängig bzw. peakabhängig) (1) Peak-based |
 |
| Im Messsignal-Einstellungsbereich können die Messsignale der Methode zu sortiert werden und mit OK (2) bestätigt werden.
(1) Signal (da nur ein Detektor angeschlossen ist, hat man die Wahl zwischen verschiedenen Wellenlängen).
In unserem Beispiel Methode_Doktorand_2: |
 |
| Im Report-Einstellungsbereich kann das Format des Reports angepasst werden. Da dies in den meisten Fällen für uns nicht relevant ist und später auch noch während der Auswertung entsprechend angepasst werden kann, kann hier die Editierung mit Cancel (1) abgebrochen werden. |  |
| Anschließend wird der Abbruch mit OK (1) bestätigt. |
 |
| Zuletzt muss die Methode gespeichert werden (1, 2) und ein gewünschter Methodenname gewählt werden (3, 4). Ein Kommentar zur Änderung ist nicht nötig einfach mit OK (5) bestätigen. Die gespeicherte Methode wird automatisch geladen (6). |
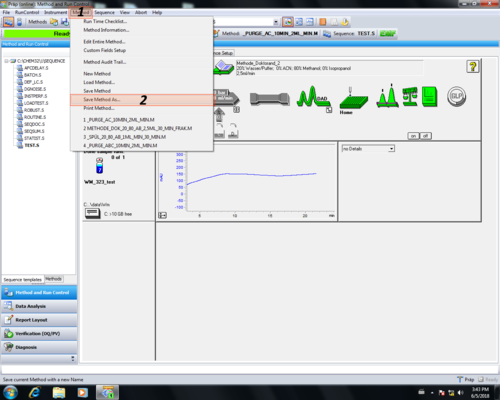    |
Messen
Nachdem durch "Purgen" die Luft aus den Zuleitungen gespült wurde kann eine zuvor erstellte Methode geladen werden und die Säule mit dem gewünschten Lösungsmittelgemisch ~30 min eingespült werden. Säulen mögen keine zu starken Wechsel in der Polarität des Laufmittels, so dass Wechsel von Laufmittelgemischen mit stark unterschiedlichen Polaritäten schrittweise erfolgen sollten, um Risse im Säulenbett vorzubeugen. Nach dem Einspülen der Säule müssen die vorbereiteten Proben in den Probentisch des Autosamplers gestellt werden und Angaben zu Position etc. in die Sequenztabelle eingetragen werden.
Probentabelle erstellen
Messung starten
Spülen
Hat man die letzte Messung beendet muss die Säule gespült werden und im vom Hersteller angegebenen Lösungsmittelgemisch gelagert werden. Üblicherweise werden die Säulen 20-30 min mit einem Lösungsmittelgemisch gespült, welches einen höheren organischen Anteil hat als jenes, welches zuvor für die Messung verwendet wurde. Hierfür lädt man am besten eine entsprechende Spülmethode. Nach dem Spülen wechselt man dann zum vom Hersteller angegebenen Lösungsmittelgemisch und konditioniert sie für weitere 10 min, bevor man die Pumpe im Programm ausschaltet.
Schließen
Auswerten
Die Auswertung kann entweder an Hand des ausgedruckten Reports oder an Hand eines im offline Programm (Präp LC offline) von Chemstation modifizierten Reports erfolgen. Von Interesse sind hierbei insbesondere die Retentionszeiten und Integrale der einzelnen Signale, auch das UV-Spektrum der einzelnen Signale gibt wichtige Hinweise.
Abschließende Hinweise
Vor Verwendung der HPLC ist es sinnvoll seine Zielsetzung klar zu definieren. Für eine gute Dokumentation bietet es sich an bei jeder Messung einen Laufzettel zu verwenden, in dem alle Parameter der Messung vermerkt sind, um eine Reproduzierbarkeit bei erneuten Messungen zu gewährleisten. Ein Vordruck kann hier oder im Desktopbereich des HPLC-Computers gefunden werden und bei Bedarf ausgedruckt werden.