Agilent 1100/1200 semipräparativ
Aufbau
Eine HPLC setzt sich aus verschiedenen Baugruppen zusammen. Die semipräparative HPLC von Agilnet aus Raum 318 besteht aus folgenden Baugruppen.
 | |||||
|---|---|---|---|---|---|
| Baugruppe | Produktnummer/ Seriennummer | Foto | Herstelleranleitung | ||
| Lösungsmittel Kabinett |  |
||||
| Degasser/ Entgasser | G1379A/ JP13208442 | Degasser | |||
| Pumpe | G1311A/ DE82203503 |  |
quaternäre Pumpe | ||
| Autosampler/ Injektor | G1313A/ DE11116863 |  |
Autosampler; | ||
| DAD-Detektor | G1315A/ DE82203687 |  |
DAD-Detektor | ||
| Fraktionssammler | G1364C/ DE63055760 |  |
Fraktionssammler | ||
| Steuerelement | G132B/ CN23607228 |  |
Steuerelement | ||
| Säulenofen | ST 85P jet/ 50521 |  |
Säulenofen | ||
| Lösungsmittelabfall Hinterkolbenspülung |  |
||||
| Lösungsmittelabfall (Purgeventil (Pumpe)/ Injektor/ Fraktionssammler) |  |
||||
| Rechner (Windows 7) |  |
||||
Vorbereitung
Säule
Vor der Inbetriebnahme der HPLC muss die gewünschte Säule eingebaut werden falls diese nicht bereits eingebaut ist. Es ist darauf zu achten, dass die verwendete Säule den gewünschten Bedingungen stand hält (pH, Druck, Lösungsmittel etc.). Bei Einbau ist darauf zu achten, dass die Anschlüsse alle dicht sind. Nach dem Einbau der Säule, kann diese wenn gewünscht im Säulenofen temperiert werden.
Lösungsmittel
- Vor jeder Messung ist es nötig den Füllstand der Lösungsmittelflaschen zu überprüfen.
- Es ist darauf zu achten, dass nur Lösungsmittel entsprechender Qualität verwendet werden. In ihnen dürfen sich keine Partikel befinden. Diese würden die Kapillaren und Ventile verstopfen. Korrosive Lösungen (z.B. Alkalilösungen, Salzlösungen und Halogensäuren) dürfen nicht verwendet werden.
- Die Lösungsmittel müssen mit der verwendeten Säule kompatibel sein, auch in Bezug auf pH-Wert.
- Bei Flussraten größer 2 ml/min empfiehlt es sich die verwendeten Lösungsmittel zuvor zu entgasen.
- Bei der Verwendung von Puffer-Lösungen müssen diese zuvor filtriert werden.
- Um bakterielles Wachstum zu unterbinden ist der Zusatz von 0,1 % TFA zum Lösungsmittel sinnvoll, ansonsten muss das Wasser bzw. Puffer alle 2 Tage getauscht werden.
Abfall
Alle Abfallbehälter sollten vor Messbeginn geprüft werden und gegebenenfalls geleert oder ausgetauscht werden ( Hinterkolbenspülung nicht vergessen).
Proben
Die Probenvorbereitung ist ein wichtiger Teil der HPLC-Analyse. Um Kontamination der Säule das Ausfallen der Probe auf der Säule zu vermeiden, ist es wichtig die Probe in einem entsprechenden Lösungsmittelverhältnis zu lösen und zu filtrieren. Die Probe sollte zu jeder Zeit gelöst sein und dürfen nicht im Laufmittelgemisch ausfallen. So ist es nicht sinnvoll bei RP-Phase die Probe in reinem Methanol oder ACN zu lösen, da die Gefahr groß ist, dass die Probe bei einem polareren Laufmittelgemisch auf der Säule ausfällt und nicht über die Säule transportiert wird. Das Ausfallen von Proben auf der Säule verursacht zum einen eine Steigerung des Rückdrucks bis hin zur Verstopfung der Säule, zum anderen die Bildung von Kanälen im Säulenmaterial, welches die Trennleistung verschlechtert.
In welchem Lösungsmittelgemisch soll ich nun meine Probe lösen?
Diese Frage kann nicht pauschal beantwortet werden. Es ist wichtig das sie dauerhaft in Lösung ist. Wie kann man dies praktisch machen? Zunächst wiegt man z.B. etwa 1 mg seiner Probe ab und versucht dieses in 500 µL reinem Methanol bzw. ACN zu lösen. Ist dies möglich (klare Lösung) kann in 100 µL Schritten Wasser zugegeben werden, und gleichzeitig beobachtet werden ob etwas ausfällt (Lösung sich eintrübt). Hat man insgesamt 500 µL zu gegeben und die Lösung ist noch klar kann man diese mit einem Spritzenfilter in ein Vial filtrieren. Man hat nun eine Probenlösung mit einem Lösungsmittelverhältnis von 50:50 (Methanol/ACN:Wasser) und kann jetzt ohne Gefahr, dass die Probe ausfällt, alle Laufmittelmischungsverhältnisse zwischen 100% Methanol/ACN und 50:50 Methanol/ACN:Wasser verwendet. Will man für die Trennung ein Laufmittelmischungsverhältnis verwenden, welches einen höheren Wasseranteil hat muss zuvor eine anderes Probenlösungsmittelverhältnis gewählt werden. Fällt während der Zugabe die Probe aus so verringert sich der Laufmittelmischungsverhältnis-Bereich entsprechend.
Fraktionssammler
Falls der Fraktionssammler verwendet werden soll muss dieser zuvor mit Probengläschen bestückt werden.
Starten
Vor dem Starten der HPLC ist es wichtig die entsprechenden Vorbereitungen (siehe vorherigen Absatz) zu treffen.
| Erklärung | Bild |
|---|---|
Zum Starten der HPLC müssen zunächst die einzelnen Bauelemente angeschaltet werden.
|
 |
| Um die semipräparative HPLC zu starten muss zunächst die Verknüpfung "Präp LC online" mit einem Doppelklick (linke Maustaste) geöffnet werden. |  |
| Nach dem Klicken verbinden sich die Bauelemente der HPLC mit dem Rechner. |   |
| Nach dem sich der Fraktionssammler initialisiert hat (1)
(~2 min, hierfür muss er geschlossen sein!!), muss eine Methode geladen werden (2). |
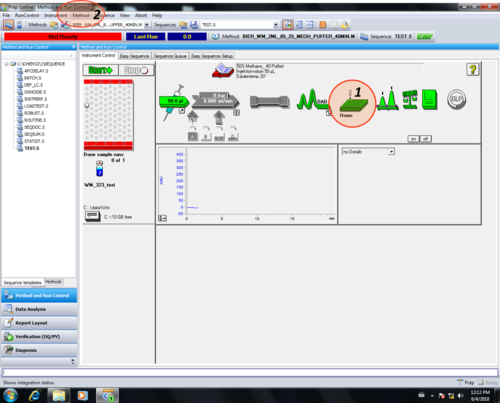 |
| Hierfür wird der Menüreiter "Load Method" (1) ausgewählt. |  |
Im erscheinenden Menü wird eine der Purge-Methoden, abhängig von bei der Messung verwendeten Kanälen, gewählt. Will man z. B. später mit einer Mischung aus Methanol (Kanal C) und Wasser (Kanal A) die HPLC betreiben würde man Methode "_PURGE_AC_10MiN_2ML_MIN" (1, 2) verwenden.
|
 |
| Die Ausgewählte Methode wird im Programm angezeigt (1). | 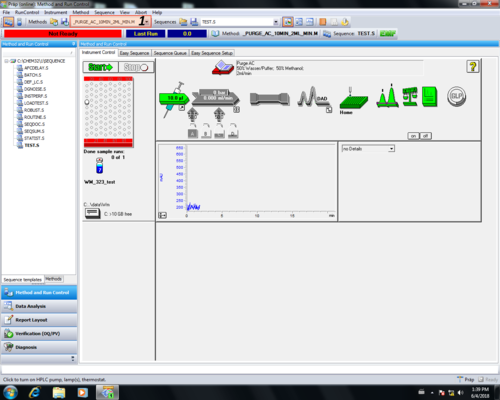 |
| Um das HPLC-System zu reinigen muss das Purgeventil geöffnet werden (1) und die HPLC gestartet werden (2). |   |
| Dabei wird die Pumpe und der DAD-Detektor ininitialisiert. Im Schaubild färbt sich sobald das System bereit ist der "Pumpenpfeil" und die "DAD-Detektorwelle" grün. Danach läuft über den Purgeventil-Auslauf Lösungsmittel in den Lösungsmittelabfall. Die Lösungsmittelzuleitungen sollten 5-10 min gespült werden. Im Schlauchsystem von Lösungsmittelkabinett bis Purgeventil-Auslauf sollten idealerweise keine Luftblasen sein. Der eingebaute Degasser hat nur eine begrenzte Kapazität, so dass es bei hohen Flussraten nicht zur vollständigen Entgasung kommt. |    |
| Nach dem Reinigen wird die Pumpe in "Standby" geschaltet, dabei färbt sich der der"Pumpenpfeil" grau (1, 2, 3, 4). Danach muss das Purgeventil geschlossen (5) werden. |   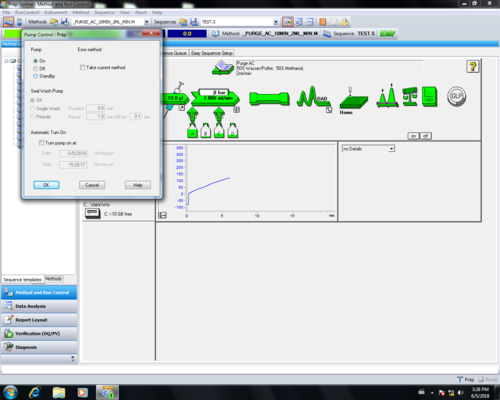 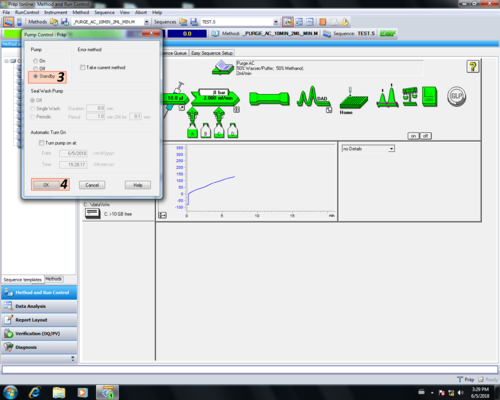   |
Methode editieren/ erstellen
Um Substanzen auf der HPLC zu trennen braucht man eine Methode. Der einfachste Weg eine neue Methode zu erstellen besteht im editieren einer vorhandenen Methode.
| Erklärung | Bild |
|---|---|
| Zum editieren eine Methode muss der Menüreiter "Methode" ausgewählt werden (1) und " Edit Entire Methode..." angeklickt werden (2). |  |
| Die Editierung aller Bereiche mit Ok (1) bestätigen. |  |
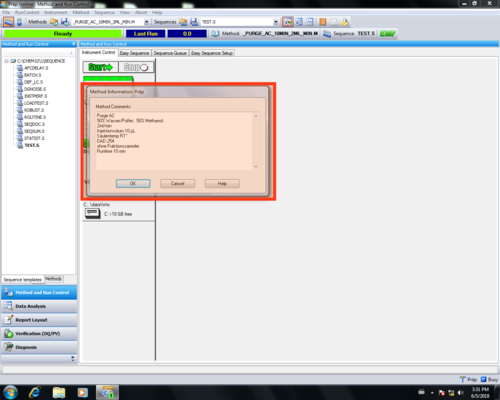
Im Methoden Informationsbereich sollte eine Übersicht der Methodenparameter eingetragen werden (1) und mit OK (2) bestätigt werden.
Diese Informationen bilden die den Header des Reports einer Messung. |
 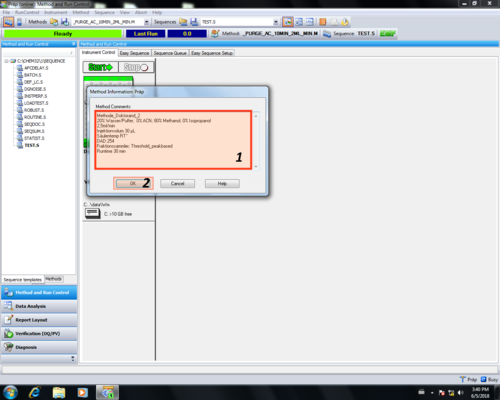 |
Im Pump-Einstellungsbereich können pumpenrelevante Parameter eingetragen werden und mit OK (6) bestätigt werden.
|
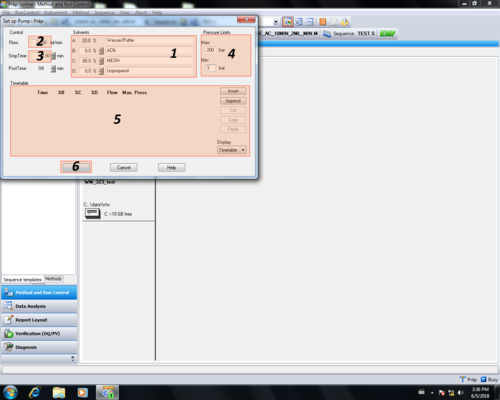 |
Im Injektions-Einstellungsbereich können injektionsrelevante Parameter eingetragen werden und mit OK (3) bestätigt werden.
In unserem Beispiel Methode_Doktorand_2:
|
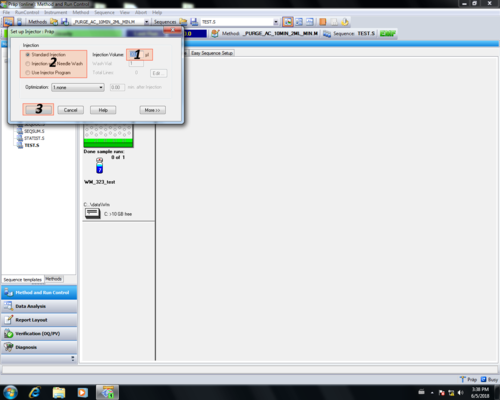 |
Im DAD-Detektor-Einstellungsbereich können detektorrelevante Parameter eingetragen werden und mit OK (5) bestätigt werden.
In unserem Beispiel Methode_Doktorand_2:
|
 |
Im Fraktionssammler-Einstellungsbereich können Parameter, die den Fraktionssammler betreffen, eingetragen werden und mit OK (5) bestätigt werden.
|
 |
Im Messsignal-Einstellungsbereich können die Messsignale der Methode zusortiert werden und mit OK (2) bestätigt werden.
|
 |
| Im Report-Einstellungsbereich kann das Format des Reports angepasst werden. Da dies in den meisten Fällen für uns nicht relevant ist und später auch noch während der Auswertung entsprechend angepasst werden kann. Kann hier die Editierung mit Cancel (1) abgebrochen werden.
|
 |
| Anschließend wird der Abbruch mit OK (1) bestätigt. |

|
| Zuletzt muß die Methode gespeichert werden (1, 2) und ein gewünschter Methodenname gewählt werden (3, 4). Eine Kommentar zur Änderung ist nicht nötig einfach mit OK (5) bestätigen. Die gespeicherte Methode wird automatisch geladen (6). |
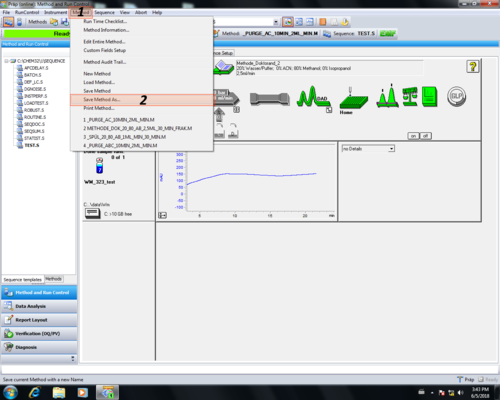    |
