La Chrom HPLC D-7000: Unterschied zwischen den Versionen
Cbier (Diskussion | Beiträge) Keine Bearbeitungszusammenfassung |
Cbier (Diskussion | Beiträge) Keine Bearbeitungszusammenfassung |
||
| Zeile 158: | Zeile 158: | ||
*[[File:Method Configuration.png|30px]] '''Method Configuration''' Use this command if you want to review or modify Method Configuration parameters. | *[[File:Method Configuration.png|30px]] '''Method Configuration''' Use this command if you want to review or modify Method Configuration parameters. | ||
*[[File:Method Information.png|30px]] [['''Method Information''' | *[[File:Method Information.png|30px]] [[Method Information|'''Method Information''']] Use this command if you want to review or modify general Method information such as the Method title, Method name, or solvent names. | ||
*[[File:Pump Setup.png|30px]][['''Pump Setup''' | *[[File:Pump Setup.png|30px]][[Pump Setup|'''Pump Setup''']] Use this command if you want to review or modify pump parameters or the solvent table. | ||
*[[File:Autosampler_Setup.png|30px]] [['''Autosampler Setup''' | *[[File:Autosampler_Setup.png|30px]] [[Autosampler Setup|'''Autosampler Setup''']] Use this command if you want to review or modify autosampler parameters. | ||
*[[File:Channel_1-DAD_Setup.png|30px]][[File:Channel_2-RI_Setup.png|30px]] [[ | *[[File:Channel_1-DAD_Setup.png|30px]][[File:Channel_2-RI_Setup.png|30px]] [[Channel 1 or 2 Detector Setup|'''Channel 1 or 2 Detector Setup''']] Use these commands if you want to review or modify the parameters of the detectors on channel 1 or channel 2. | ||
*[[File:Event Signal.png|30px]] [['''Event Signal Setup''' | *[[File:Event Signal.png|30px]] [[Event Signal Setup|'''Event Signal Setup''']] Use this command to initiate the review or modification of Event Signal parameters. | ||
*[[File:Time Summary.png|30px]] [['''Time Summary''' | *[[File:Time Summary.png|30px]] [[Time Summary|'''Time Summary''']] Use this command to display the pump (solvent) table and event table graphically. | ||
*[[File:Channel 1.png|30px]][[File:Channel 2.png|30px]] [[ | *[[File:Channel 1.png|30px]][[File:Channel 2.png|30px]] [[Channel 1 or Channel 2|'''Channel 1 or Channel 2''']] Use these commands to select a channel (1 or 2) for the subsequent review or modification of data processing parameters. | ||
*[[File:Calculation Method.png|30px]] [['''Calculation Method''' | *[[File:Calculation Method.png|30px]] [[Calculation Method|'''Calculation Method''']] Use this command to review or modify the calculation method. | ||
*[[File:Component Table.png|30px]] [['''Component Table''' | *[[File:Component Table.png|30px]] [[Component Table|'''Component Table''']] Use this command to review or modify the Component Table. | ||
*[[File:Integration Time Table.png|30px]] [['''Integration Time Table''' | *[[File:Integration Time Table.png|30px]] [[Integration Time Table|'''Integration Time Table''']] Use this command to review or modify the Integration Time Table. | ||
*[[File:Data_Processing.png|30px]] [['''DAD Data Processing''' | *[[File:Data_Processing.png|30px]] [[DAD Data Processing|'''DAD Data Processing''']] Use this command to review or modify DAD data processing parameters. | ||
*[[File:Chromatogram Display Format.png|30px]] [['''Chromatogram Display Format''' | *[[File:Chromatogram Display Format.png|30px]] [[Chromatogram Display Format|'''Chromatogram Display Format''']] Use this command to review or modify parameters. | ||
*[[File:DAD_Display_Format.png|30px]] [['''DAD Display Format''' | *[[File:DAD_Display_Format.png|30px]] [[DAD Display Format|'''DAD Display Format''']]Use this command to review or modify DAD display format parameters. | ||
*[[File:Confiedence Report.png|30px]] [['''Confidence Report''' | *[[File:Confiedence Report.png|30px]] [[Confidence Report|'''Confidence Report''']] Use this command to review or modify confidence report parameters. | ||
*[[File:Report Format.png|30px]] [['''Report Format''' | *[[File:Report Format.png|30px]] [[Report Format|'''Report Format''']] Use this command to review or modify report format parameters. | ||
*[[File:Update Format.png|30px]] [['''Update Method''' | *[[File:Update Format.png|30px]] [[Update Method|'''Update Method''']] Use this command to update all parameters of current Method to all other open windows. | ||
|style="text-align:left; vertical-align:top;"| [[File:L15_2.png|top|center|thumb|500px|Methode laden]] | |style="text-align:left; vertical-align:top;"| [[File:L15_2.png|top|center|thumb|500px|Methode laden]] | ||
|- | |- | ||
Version vom 7. August 2018, 14:50 Uhr
!!!Use the operator book!!! DO NOT FORGET!!!!
Everybody who is using the HPLC should enter his name, the uesed colum, the solvent mixture and the back pressure of the system in the user book.
Assembly
A HPLC consists of different parts. The La Chrom HPLC D-7000 in room 118 is made up of the folowing modules
| Module | Product Number | Picture | Manual | ||
|---|---|---|---|---|---|
| Solvent bottles | |||||
| Pump | L7100 | Quaternary Pump | |||
| Autosampler/ Injector | L-7200 | Autosampler | |||
| Interface | D-7000 | Interface | |||
| DAD-Detector | L-7455 | DAD-Detector | |||
| RI-Detector | L-7490 | RI-Detector | |||
| Column Switcher | BESTA-High-Pressure-Motorvalve | Column Switcher | |||
| Column Oven | L-7350 | Column Oven | |||
| Solvent Waste | |||||
| Computer (Windows 2000) | |||||
Preparations
Column
The HPLC is connected to a column switcher, which gives you the opportunity to choose between five different columns. If the column you want to use isn´t included you have to change one of the columns. The method you want to use should be compatible with the conditions the column can stand (pH, pressure, solvent etc.). After the installation you should take care, that all connections are tight. All columns can be tempered in the column oven.
Solvent
* Before starting a measurement, the solvent level should be checked and if necessary refilled. Don´t forget to check the Autosampler solvent bottle. *All used solvents have to be degassed and be compatible with the used column. Especially the RI-Detector won´t work with not proper degassed solvents. * It is required, that all solvents have HPLC quality and are particle free. Small particles can permanently block the capillaries and valves. Avoid the use of the following steel-corrosive solvents: #Solutions of alkali halides and their respective acids (for example, lithium iodide, potassium chloride, and so on). #High concentrations of inorganic acids like sulfuric acid, especially at higher temperatures (replace, if your chromatography method allows, by phosphoric acid or phosphate buffer which are less corrosive against stainless steel). #Chromatographic grade ethers, which can contain peroxides (for example, THF, dioxane, diisopropylether) such ethers should be filtered through dry aluminium oxide which adsorbs the peroxides. #Halogenated solvents or mixtures, which form radicals and/or acids, for example: ::2CHCl3 + O2 → 2COCl2 + 2HCl ::This reaction, in which stainless steel probably acts as a catalyst, occurs quickly with dried chloroform if the drying process removes the stabilizing alcohol. Prevent Blocking of Solvent Filters Contaminated solvents or algae growth in the solvent bottle will reduce the lifetime of the solvent filter and will influence the performance of the pump. This is especially true for aqueous solvents or phosphate buffers (pH 4 to 7). The following suggestions will prolong lifetime of the solvent filter and will maintain the performance of the pump: * Use sterile, if possible amber, solvent bottles to slow down algae growth. * Filter solvents through filters or membranes that remove algae. * Exchange solvents every two days or refilter. * If the application permits add 0.0001–0.001 M sodium azide or 0.1 % TFA to the solvent. * Avoid exposure of the solvent bottles to direct sunlight. * When using buffer solutions, flush the system with water before switching it off. NOTE Never use the system without solvent filter installed.
Waste
Before the use of the HPLC, the waste container should be checked and emptied if necessary.
Sample
The sample preparation is an important part of the HPLC analysis. It is important, that the sample is dissolved and filtered before the measurement. This prevents the contamination of the column and the precipitation of the sample on the column bed. The sample has to be dissolved at any time and shouldn´t precipitated from the eluent. Therefor it is not thoughtful to dissolve the sample in pure methanol or acetonitrile, if you are working with an RP-phase column. The risk of sample precipitation during the measurement is to high. Sample precipitation causes a rising of the back pressure and clogging of the column, which leads to an irreversible poor resolution.
What is the right solvent mixture to dissolve many sample?
This question can´t be answered easily and depends on the sample. The most important thing is, that the sample is in solution during the whole measurement. How can you find the right solvent mixture? One way is to do this in practice is the following: At first take 1 mg of your sample and dissolve it in 500 µL HPLC Methanol respectively ACN. Is the solution still clear you can successively add water in 100 µL steps. After each addition check if the solution is still clear. If the solution is clear go on with addition until you reach a total volume of 1000 µL. If it becomes cloudy stop the addition of water and add 100 µL of HPLC Methanol respectively ACN. The precipitated sample should dissolve again. Then calculate the solvent ratio. This is the maximum solvent ratio you can use for the eluent without the risk of precipitation of the sample on the column bed. Solvent mixtures with higher amount of water would lead to precipitation. To get rid of remaining particles, the sample solution is filtered with a syringe filter.
Start
Bevor you start the HPLC it is important to make preparations (see previous paragraph).
| Explanation | Picture |
|---|---|
| If you want to start the HPLC you have to switch on the different parts of the HPLC-assembly. # Pump # Interface/ Interface # Autosampler/ Injector # RI-Detector # DAD-Detector # Column Oven # Column Switcher # Computer (if it is not already running) | |
| Open the programm "D 7000- HSM" by double clicking the shortcut with the left mouse button. | |
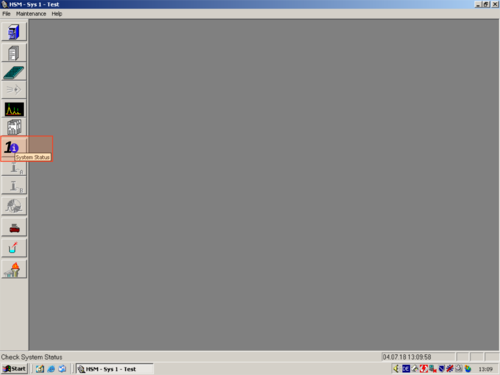
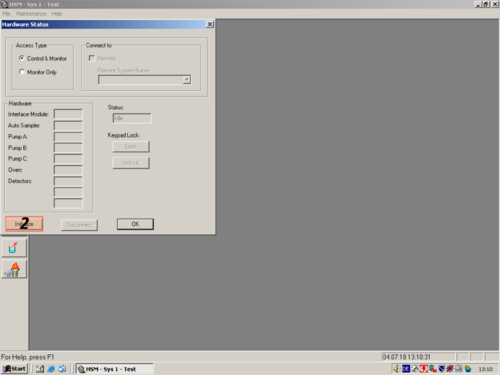
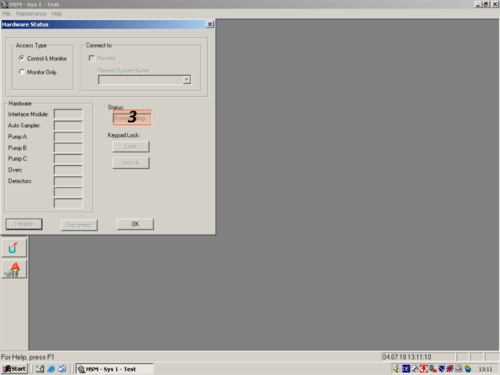
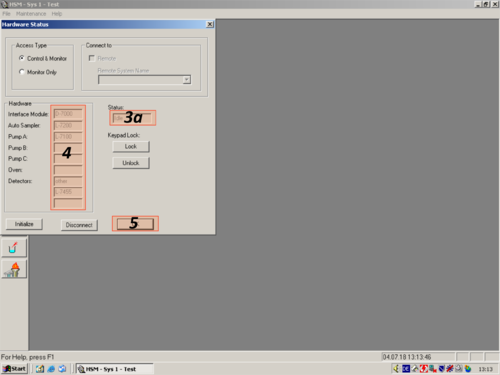
| After the programm has opened click the white " i " (1) on blue ground. A window opens and shows you the hardware status. For connecting the computer with the HPLC click on " Initialize" (2). The status changes to "Downloading" (3). After a while the HPLC and computer are connected and the status changes to "Idle" (3a). All connected parts are shown on the left (4). The connection then can be confirmed with "OK" (5). | |
| After the HPLC is connected to the computer you have to purge the system. To purge it manually is the easiest way to do it.
*Manually set the pump (Manual set |
|
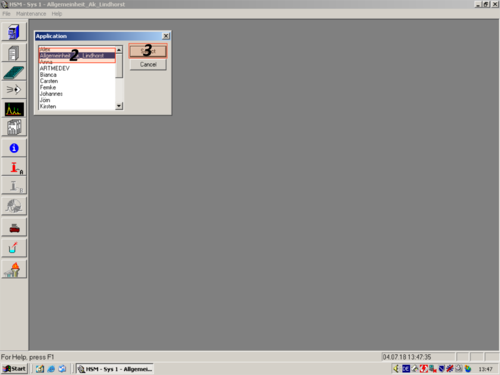
| When you are finished purging the system you have to choose the applications of a certain operator. In our case "Allgemeinheit Lindhorst" (1, 2, 3). |
Method creating/editing
To be able to separate substances with the HPLC it is nesassary to setup a method. The easiest way to creat a method is by editing an existing method.
| Explanation | Picture |
|---|---|
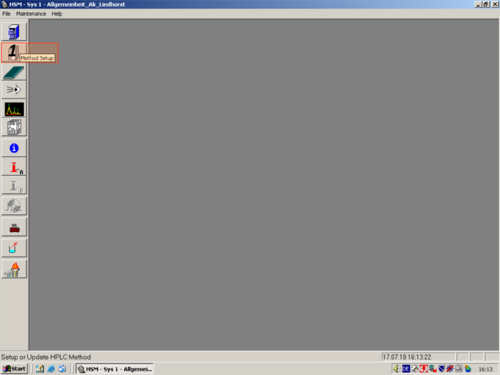
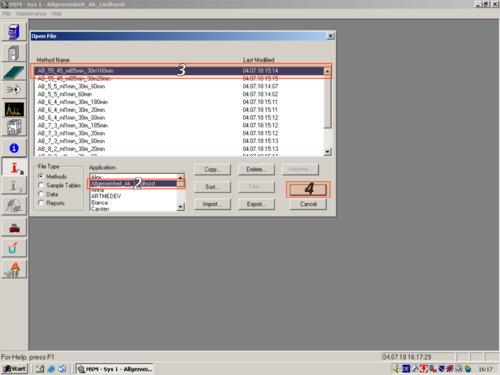
| Click on "Method Setup" and choose a method you want to edit (1,2,3,4) | |
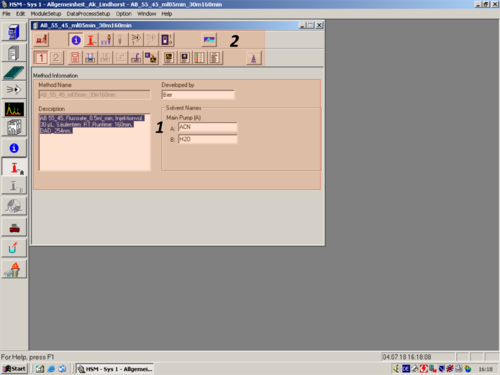
| A window opens and shows the general information of the choosen method (1). This infomation can be changed to the desired ones. The different Icons give you the chance to change all kind of method parameters (2).
* |
|
| Die Ausgewählte Methode wird im Programm angezeigt (1). | |
| Um das HPLC-System zu reinigen muss das Purgeventil geöffnet werden (1) und die HPLC gestartet werden (2). | |
| Dabei wird die Pumpe und der DAD-Detektor initialisiert. Im Schaubild färbt sich sobald das System bereit ist der "Pumpenpfeil" und die "DAD-Detektorwelle" grün. Danach läuft über den Purgeventil-Auslauf Lösungsmittel in den Lösungsmittelabfall. Die Lösungsmittelzuleitungen sollten 5-10 min gespült werden. Im Schlauchsystem von Lösungsmittelkabinett bis Purgeventil-Auslauf sollten idealerweise keine Luftblasen sein. Der eingebaute Degasser hat nur eine begrenzte Kapazität, so dass es bei hohen Flussraten nicht zur vollständigen Entgasung kommt. | |
| Nach dem Reinigen wird die Pumpe in "Standby" geschaltet, dabei färbt sich der"Pumpenpfeil" grau (1, 2, 3, 4). Danach muss das Purgeventil geschlossen (5) werden. |
Methode editieren/ erstellen
Um Substanzen auf der HPLC zu trennen braucht man eine Methode. Der einfachste Weg eine neue Methode zu erstellen besteht im editieren einer vorhandenen Methode.
| Erklärung | Bild |
|---|---|
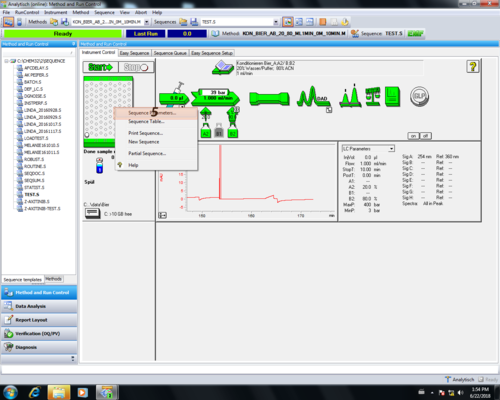
| Zum editieren eine Methode muss der Menüreiter "Methode" ausgewählt werden (1) und " Edit Entire Methode..." angeklickt werden (2). | |
| Die Editierung aller Bereiche mit Ok (1) bestätigen. | |
| Im Methoden Informationsbereich sollte eine Übersicht der Methodenparameter eingetragen werden (1) und mit OK (2) bestätigt werden. *Name *Lösungsmittel-Mischungsverhältnis *Flussrate *Injektionsvolumen *Säulenofentemperatur *Detektorwellenlänge *Methodendauer In unserem Beispiel: *Methode_Doktorand_2 *20 % Wasser/Puffer; 80 % Acetonitril; *0,5 mL/min *20 µL *RT *254 nm *30 min Diese Informationen bilden die den Header des Reports einer Messung. | |
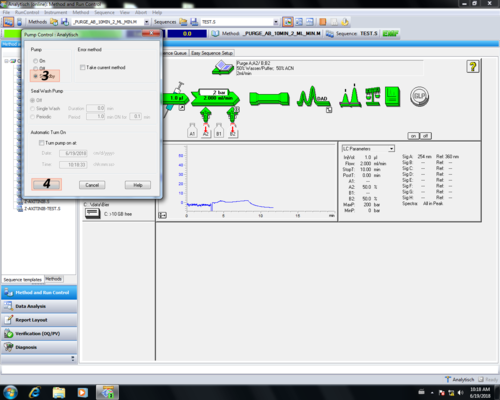
| Im Pump-Einstellungsbereich können pumpenrelevante Parameter eingetragen werden und mit OK (6) bestätigt werden. :(1) Lösungsmittel-Mischungsverhältnis :(2) Flussrate :(3) Methodendauer :(4) Druck-Limits :(5) Gradienten Einstellungen In unserem Beispiel Methode_Doktorand_2: :(1) 20 % Wasser/Puffer; 80 % Acetonitril; :(2) 0,5 mL/min :(3) 30 min :(4) 3-200bar (untere Druck nur beim Purgen auf 0 bar setzen, ansonsten besteht die Gefahr, dass die Säule trocken läuft. Das ober Drucklimit ist durch die Druckbeständigkeit des Säulenmaterials und des DAD-Detektors begrenzt. :(5) isokratisch | |
| Im Injektions-Einstellungsbereich können injektionsrelevante Parameter eingetragen werden und mit OK (3) bestätigt werden. :(1) Injektionsvolumen :(2) Injektionsart In unserem Beispiel Methode_Doktorand_2: :(1) 20 µL :(2) Standard | |
| Im DAD-Detektor-Einstellungsbereich können detektorrelevante Parameter eingetragen werden und mit OK (5) bestätigt werden. :(1) Substanzwellenlängen (Wellenlänge bei dem die Substanz ::absorbiert), Referenzwellenlänge (liegt in der Regel höher als die zugehörige Signalwellenlänge, hier sollte das Lösungsmittel nicht absorbieren) :(2) Detektionszeit (stimmt in der Regel mit Methodendauer ::überein) :(3) verwendete Lampen (Lampen decken unterschiedliche ::Wellenbereiche ab UV bzw. Vis) :(4) UV-Spektrum (hier wird eingestellt zu welchem Zeitpunkt ::ein gesamtes UV-Absorptionsspektrum online mitgemessen wird) In unserem Beispiel Methode_Doktorand_2: :(1) Sub: 254 nm; Ref:360nm :(2) 30 min :(3) UV & Vis :(4) All in peak | |
| Im Messsignal-Einstellungsbereich können die Messsignale der Methode zu sortiert werden und mit OK (2) bestätigt werden. :(1) Signal (da nur ein Detektor angeschlossen ist, hat man :: die Wahl zwischen verschiedenen Wellenlängen) In unserem Beispiel Methode_Doktorand_2: :(1) DAD1 A, Sig=254nm | |
| Im Report-Einstellungsbereich kann das Format des Reports angepasst werden. Da dies in den meisten Fällen für uns nicht relevant ist und später auch noch während der Auswertung entsprechend angepasst werden kann. Kann hier die Editierung mit Cancel (1) abgebrochen werden. | |
| Anschließend wird der Abbruch mit OK (1) bestätigt. | |
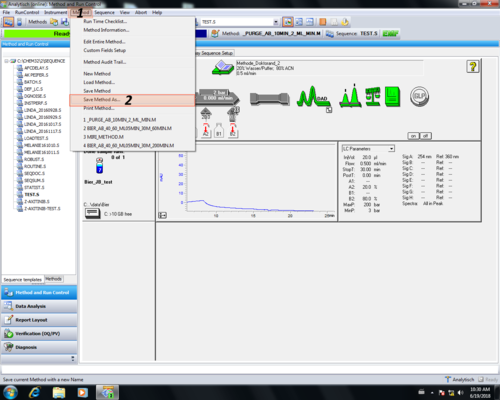
| Zuletzt muss die Methode gespeichert werden (1, 2) und ein gewünschter Methodenname gewählt werden (3, 4). Ein Kommentar zur Änderung ist nicht nötig einfach mit OK (5) bestätigen. Die gespeicherte Methode wird automatisch geladen (6). |
Messen
Nachdem durch "Purgen" die Luft aus den Zuleitungen gespült wurde kann eine zuvor erstellte Methode geladen werden und die Säule mit dem gewünschten Lösungsmittelgemisch ~30 min eingespült werden. Säulen mögen keine zu starken Wechsel in der Polarität des Laufmittels, so dass Wechsel von Laufmittelgemischen mit stark unterschiedlichen Polaritäten sukzessiv erfolgen sollten, um Risse im Säulenbett vorzubeugen. Nach dem Einspülen der Säule müssen die vorbereiteten Proben in den Probentisch des Autosamplers gestellt werden und Angaben zu Position etc. in die Sequenztabelle eingetragen werden.
Probentabelle erstellen
| Erklärung | Bild |
|---|---|
| Zum Erstellen der Sequenztabelle muss zunächst das Probentischsymbol angeklickt werden (1) und der Menüreiter "Sequence table" ausgewählt werden. (2). | |
| In der sich öffnenden Sequenztabelle kann die Position des Vials (1), der Name der Probe (2) die gewünschte Methode (3) und die Anzahl der Injektionen/Messungen (4) der Probe eingegeben werden. Will man mehr als eine Probe messen kann man durch klicken von "Insert" (5) eine neue Zeile oberhalb, durch klicken von "Append Line" (6) eine Zeile unterhalb einfügen und wie zuvor ausfüllen. Mit " Undo All" (7) stellt man den Ursprung der Tabelle wieder her. Nach der Eingabe aller zu vermessenden Proben wird die Eingabe mit (8) bestätigt. | |
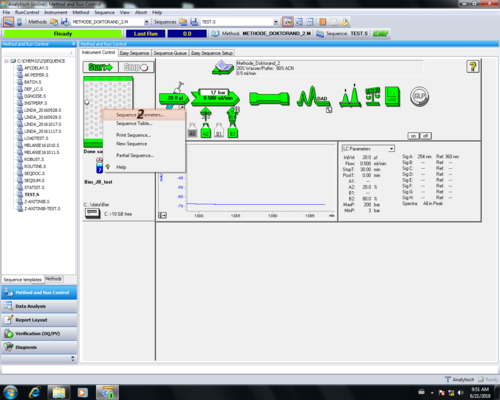
| Nachdem man zurück ins "Hauptmenü" gekommen ist muss erneut das Probentischsymbol angeklickt werden (1), aber diesmal der Menüreiter "Sequence Parameters..." ausgewählt werden. (2). | |
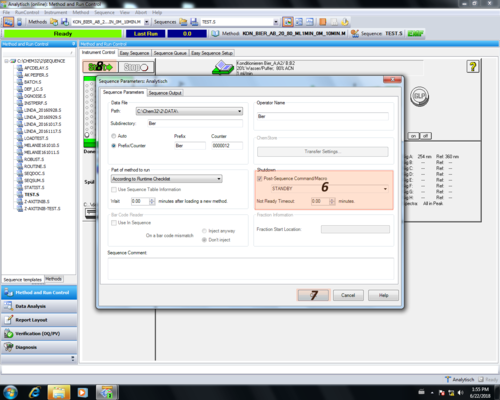
| In dem sich öffnenden Menüfenster kann der Speicherort der gemessenen Chromatogramme bestimmt werden (1). Außerdem wird hier auch der Dateiname inklusive Nummerierung festgelegt, wenn eine ganze Sequenz gemessen wird (3). In diesem Menüfenster wird auch der Anwender eingetragen der später auf dem Report erscheint (2). Hat man alle Änderungen eingetragen bestätigt man diese mit "OK" (4). |
Messung starten
| Erklärung | Bild |
|---|---|
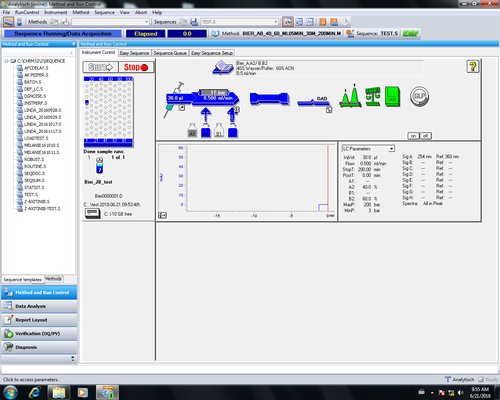
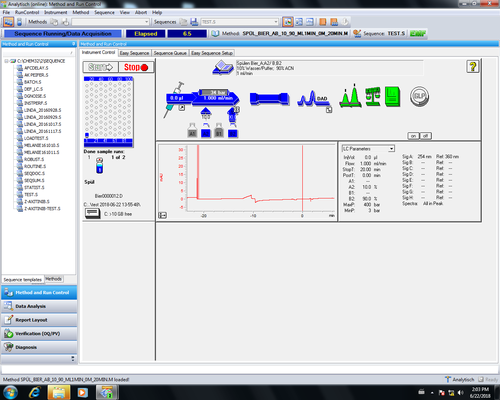
| Zurück im Hauptmenu kann durch Anklicken von Start (1) die Messung gestartet werden. Bei laufender Messung Sind die Symbole für Injektor, Säule und DAD-Detektor blau. | |
| Ist Messung fertig speichert sich automatisch das Chromatogramm beim unter "Sequence Parameter" angegebenen Ort ab und es öffnet sich ein Report den man ausdrucken kann. Die Messdaten können später auch noch offline eingesehen und ausgewertet werden. |
Spülen
Hat man die letzte Messung beendet muss die Säule gespült werden und im vom Hersteller angegebenen Lösungsmittelgemisch gelagert werden. Üblicherweise werden die Säulen 20-30 min mit einem Lösungsmittelgemisch gespült, welches einen höheren organischen Anteil hat als jenes, welches zuvor für die Messung verwendet wurde. Hierfür lädt man am besten eine entsprechende Spülmethode. Nach dem Spülen wechselt man dann zum vom Hersteller angegebenen Lösungsmittelgemisch und konditioniert sie für weitere 10 min, bevor man die Pumpe im Programm ausschaltet.
| Erklärung | Bild |
|---|---|
| Eine Möglichkeit für die Spül- und Konditionierung-Prozedur besteht im Schreiben und Starten einer entsprechender Sequenz. Dazu ruft man den "Sequence table" auf (1) und trägt hier eine Spül- (2) und Konditionierungs-Sequenz (3) ein. Anschließend bestätigt man diese mit OK (4). | |
| Im Folgenden ruft man das "Sequence Parameter" Menu auf (5). Dort kann man einstellen das sobald er mit der Messung der Sequenz fertig die UV-Lampe und die Pumpe ausgeschaltet wird (6). Diese Einstellung bestätigt man mit OK (7) und startet diese (8). |
Schließen
| Erklärung | Bild |
|---|---|
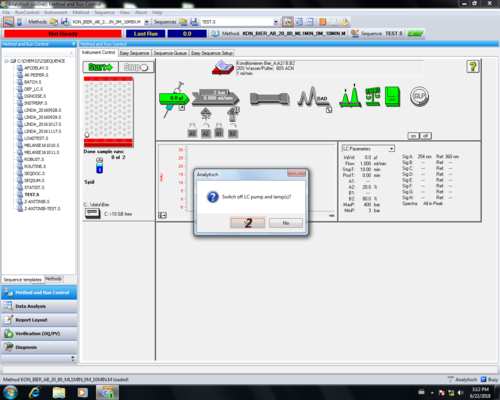
| Ist die Sequenz durchgelaufen, öffnet sich das Reportfenster und die Pumpe und die UV-Lampe schalten sich aus. Nun kann das Reportfenster geschlossen werden (1) | |
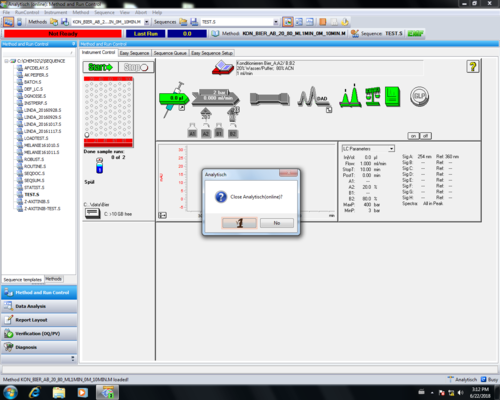
| Da die Pumpe und die UV-Lampe ausgeschalte sind (grau) (2,3), kann nun das Programm geschlossen werden (4). | |
| Die Nachfrage ob man das Programm wirklich schließen will kann einfach bestätigt werden (1), ebenso die Frage ob die Pumpe und die Lampe aus ist (2), falls diese grau unterlegt sind. |
Auswerten
Die Auswertung kann entweder an Hand des ausgedruckten Reports oder an Hand eines im offline Programm von Chemstation modifizierten Reports erfolgen. Von Interesse sind hierbei insbesondere die Retentionszeiten und Integrale der einzelnen Signale, auch das UV-Spektrum der einzelnen Signale gibt wichtige Hinweise.
Abschließende Hinweise
Vor Verwendung der HPLC ist es sinnvoll seine Zielsetzung klar zu definieren. Es bietet sich auch an für eine gute Dokumentation bei jeder Messungen ein Laufzettel zu verwenden, in dem alle Parameter der Messung vermerkt sind um eine Reproduzierbarkeit zu gewährleisten. Ein Vordruck kann hier oder im Desktopbereich des HPLC-Computers gefunden werden und bei Bedarf ausgedruckt werden.